JMLS 2022 June;7(1):0-0. 10.23005/ksmls.2022.7.1.55 Epub 2022 June 19
Copyright © 2022 by The Korean Society of Marine Life Science
Histological Description of Oogenesis in Largehead Hairtail Trichiurus lepturus (Teleostei: Trichiuridae)
So Ryung Shin; Department of Aqualife Medicine, Chonnam National University, Yeosu 59626, Korea
Hyeon Jin Kim; Department of Aqualife Medicine, Chonnam National University, Yeosu 59626, Korea
Han Young Oh; Department of Aqualife Medicine, Chonnam National University, Yeosu 59626, Korea
Jae Won Kim; Department of Smart Aquaculture, Gangwon State University, Gangneung 24525, Korea
Jung Sick Lee; Department of Aqualife Medicine, Chonnam National University, Yeosu 59626, Korea
- Abstract
연구는 갈치 Trichiurus lepturus의 성 성숙과 생식생물학적 기초 정보를 제공하기 위해 수행하였다. 난자형성과정 동안 난모세포와 핵의 크기는 증가하였으나 핵에 대한 인의 비율은 감소하였다. H-E 염색 결과, 세포질의 염색성은 호염기성에서 호산성으로 변하였다. 난황형성개시기 난모세포의 난경은 약 63.2 (±12.7) µm였다. 세포질에서는 호산성의 난황핵이 관찰되었다. 성숙기 난모세포의 난경은 216.6 (±24.7) µm였으며, GVBD (germinal vesicle breakdown)가 관찰되었다. 완숙기 난모세포의 난경은 317.9 (±80.9) µm였으며, 방사대의 두께는 4.2 (±1.7) µm였다. 난모세포의 발달형태는 난군동기발달형에 속하며, 난황 축적은 대부분의 경골어류와 마찬가지로 외재적 방법과 내재적 방법에 의한 것으로 판단되었다.
This study was conducted to provide basic information on the sexual mature and reproductive biology of Trichiurus lepturus. During the oogenesis, size of oocyte and nucleus showed the increase tendency but size ratio of nucleolus to nucleus was decreased. In the result of H-E stain, the stainability of the cytoplasm was changed from basophilic to eosinophilic. The egg diameter of initial vitellogenic oocyte was about 63.2 (±12.7) µm. In the cytoplasmic cortex, eosinophilic yolk nucleus was observed. The size of mature oocyte was 216.6 (±24.7) µm and GVBD (germinal vesicle breakdown) was observed. The size of ripe oocyte was 317.9 (±80.9) µm and the thickness of zona radiata was 4.2 (±1.7) µm. The oocyte developmental type is considered to belong to the group synchronous type. The accumulation of yolk in the oocyte, like most teleost, is thought to be of two types: exogenous and endogenous accumulation.
Keywords: Trichiurus lepturus(갈치) Oogenesis(난자형성과정)
Correspondence to: Jung Sick Lee; Department of Aqualife Medicine, Chonnam National University, Yeosu 59626, Korea; E-mail: ljs@jnu.ac.kr
- Received
- 4 May 2022;
- Revised
- 10 May 2022;
- Accepted
- 17 May 2022.
This is an Open Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Language: Korean/English,
Full Text:

경골어류의 난은 감수분열 과정의 제1난모세포 시기에 체외로 산란 된다. 따라서 경골어류의 난자형성과정은 어류의 난소 내에서 확인이 가능한 난원세포부터 산란 전 제1난모세포의 형태 및 조직학적 기준에 의해 구분한다. 난자형성과정은 난황축적과 수정을 준비하는 과정으로 핵과 세포질의 다양한 변화를 수반하는데, 이에 관한 형태 및 조직학적 정보는 종의 생식생물학적 기초자료와 생물자원의 증대 및 양식기술 개발에 매우 중요하다(Gosling, 2003). 갈치는 우리나라 연근해를 포함하여 일본, 동중국해 등 세계의 온대 및 아열대 해역에 널리 서식하며, 우리나라의 어업자원 가운데 멸치, 고등어에 이어 많은 생산량을 차지하는 중요 수산자원이다(MOF, 2022). 본 연구에서는 갈치의 난자형성과정 동안 난모세포의 조직학적 기재를 통하여 생식 생물학적 기초정보를 제공하고자 하였다.
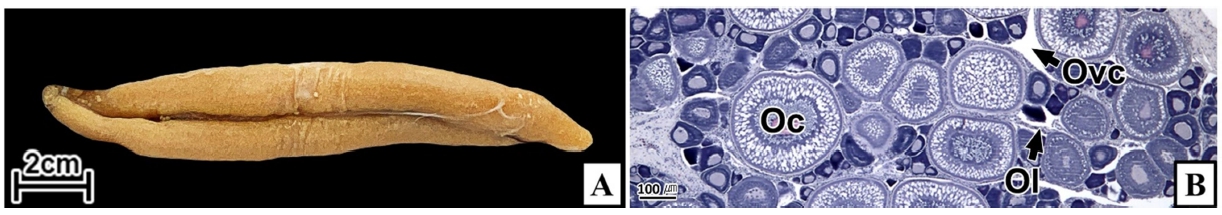
연구에 사용된 갈치는 2021년 2월부터 6월까지 거문도 해역에서 채집하였으며, 평균 전장 78.4 cm, 전중 274.4 g의 암컷 25개체였다. 조직표본 제작은 난소를 적출하여 10% 중성포르말린에 24시간 고정한 후, 난소의 중앙 부위를 횡단면으로 절취하여 파라핀 절편법에 따라 3~5 µm 두께로 연속절편하여 조직표본을 제작하였다. 조직표본은 Mayer's hematoxylin-eosin (H-E) 이중염색과 Masson 삼중염색, alcian blue-periodic acid and Schiff' solution (AB-PAS, pH 2.5) 반응을 실시하였다. 난모세포 발달단계는 Eloryduy-Garay and Ramirez-Luna (1994), Lee and Huh (2000)와 Kim et al. (2020)의 방법을 기준으로 하였다. 난모세포의 계측형질과 염색 친화도는 Kim et al. (2020)의 방법에 따라 현미경 화상분석장치(IMT, Visus, U.S.A.)를 이용하여 정량 분석하였다(Fig. 1).

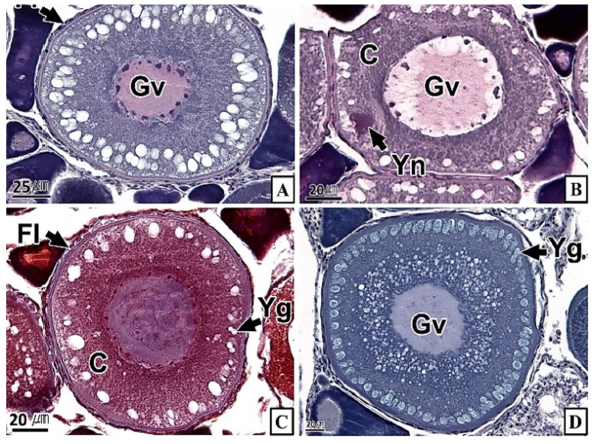
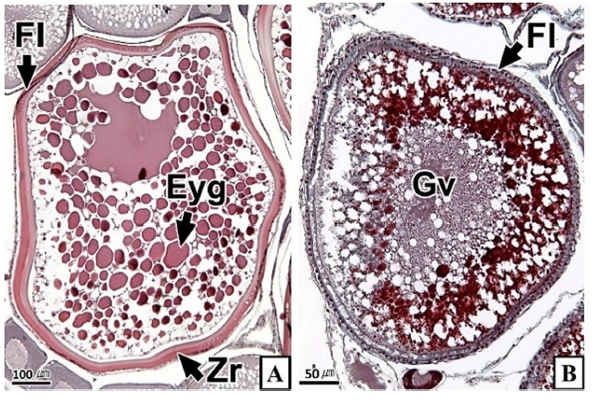
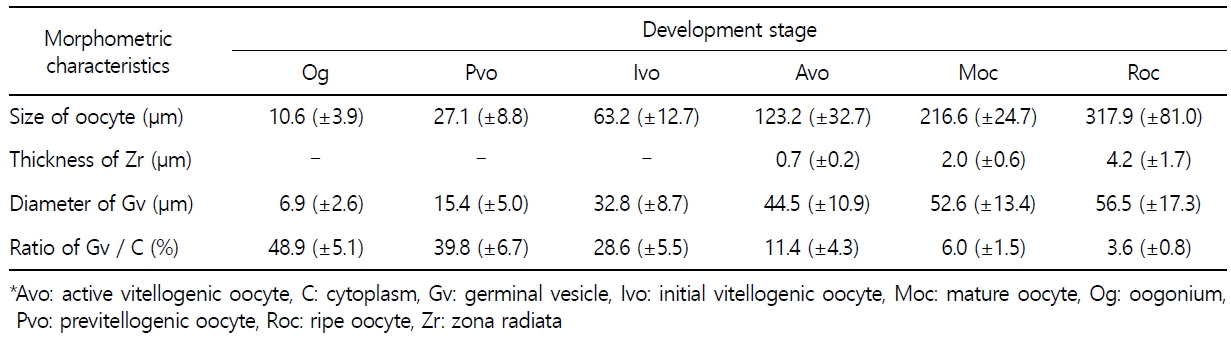
갈치 난소의 외부형태는 말단부가 뾰족한 긴 장방형의 이엽형으로 내부는 난소강, 난소소엽 및 여러 발달단계의 난모세포들로 구성되는데(Fig. 2), 이들 난모세포의 우점정도는 시기별로 차이를 보인다. 난모세포의 발달단계는 난원세포기(oogonial stage), 난황형성전기(previtellogenic stage), 난황형성개시기(initial vitellogenic stage), 난황형성활성기(active vitellogenic stage), 성숙기(mature stage), 완숙기(ripe stage)로 구분되었다. 난원세포는 원형으로 난경은 평균 10.6 (±3.9) µm였다. 핵은 원형으로 크기는 약 6.9 (±2.6) µm로 세포질의 약 48.9 (±5.1)%를 차지했다(Table 1). 세포질은 H-E 염색에서 약한 호염기성을 나타냈다. 핵질에는 불규칙한 염색사가 분포하며, 인은 관찰되지 않았다(Table 2, Fig. 3A-C). 난황형성전기 난모세포는 원형 또는 다각 타원형이었으며, 핵은 크기 약 15.4 (±4.9) µm로 난원세포에 비해 증가하였으나, 세포질에 대한 핵의 비율은 39.8 (±6.7)%로 감소하였다(Table 1). H-E 염색에서 세포질은 강한 호염기성을 나타냈으며(Table 2), 핵막을 따라 분포하는 7~10개의 인이 관찰되었다(Fig. 3D-F). 난황형성개시기 난모세포는 원형으로 난경은 약 63.2 (±12.7) µm였다. 핵의 직경은 약 32.8 (±8.7) µm로 난황형성전기에 비해 증가하였으나, 세포질에 대한 핵의 비율은 28.6 (±5.5)%로 감소하였다(Table 1). H-E 염색 결과, 세포질은 호염기성을 나타냈다(Table 2). 세포질 피질부에서는 호산성의 난황핵(yolk nucleus)이 관찰되었으며, 단층의 여포세포층이 구분되었다(Fig. 4). 난황형성활성기 난모세포의 난경은 약 123.2 (±32.7) µm였으며, 핵의 크기는 직경 약 44.5 (±10.9) µm였다. 세포질에 대한 핵의 비율은 약 11.4 (±4.3)%로 난황형성개시기에 비해 감소하였다(Table 1). 세포질은 H-E 염색에서 약한 호염기성으로 반응하였으며, 세포질의 피질부는 공포상의 난황과립들이 차지하고 있었다(Fig. 5). 방사대는 H-E 염색에서 호산성을 나타냈으며, 두께는 0.7 (±0.2) µm였다(Table 1). 성숙기 난모세포의 형태는 타원형으로 장경은 약 216.6 (±24.7) µm였다. 핵은 약 52.6 (±13.4) µm로 세포질의 약 6.0 (±1.49)%를 차지하였다(Table 1). 핵 막거치화(GVBD, germinal vesicle breakdown)와 핵의 동물극 이동이 관찰되었다. 세포질은 H-E 염색에서 호산성이었으며, 피질부 세포질은 공포상의 난황과립들이 차지하고 있었다(Fig. 6). 방사대의 두께는 약 2.0 (±0.6) µm로 전 단계에 비해 증가했다(Table 1). 완숙기 난모세포의 장경은 약 317.9 (±80.9) µm였으며, 핵은 직경 약 56.5 (±17.3) µm로 세포질에 대한 비율은 약 3.6 (±0.8)%였다(Table 1). H-E 염색 결과, 수질부 세포질의 대부분은 호산성 난황과립들이 차지했고 피질부 세포질에는 공포상의 난황과립들이 존재했다(Fig. 7). 여포세포층은 다층으로 발달했으며, 방사대 두께는 약 4.2 (±1.7) µm로 성숙기에 비해 증가하였다(Table 1).




경골어류의 난모세포 발달형태는 난소 내에 우점하는 난모세포의 분포양상에 따라 동기발달형, 난군동기발달형, 비동기발달형으로 구분되는데(Wallace and Selman, 1981), 갈치는 난군동기발달형에 속하는 것으로 판단된다. 갈치의 난자형성과정 동안 난모세포와 핵의 크기 증가, 난모세포 세포질의 호염기성에서 호산성으로 염색성 변화, 여포세포층과 방사대의 발달, 핵의 거치화 및 동물극으로의 이동 등은 주둥치 Leiognathus nuchalis (Lee and Huh, 2000)를 비롯한 많은 경골어류와 유사하였다. 경골어류의 난모세포 발달과정 중 난황축적의 방법은 외재적 방법(exogenous vitellogenesis)과 내재적 방법(endogenous vitellogenesis)으로 구분되는데, 여포세포층과 방사대의 발달은 외재적 난황축적과 밀접한 관계가 있으며, 난황핵과 인의 발달 그리고 핵 거치화는 내재적 난황축적과 밀접한 관계가 있다(Beams and Sekhon, 1966; Wallace and Selmen, 1981; Sawaguchi et al., 2006). 난황핵은 난자형성과정 중의 난모세포에서 볼 수 있는 난황의 자가합성과 연관된 구조로서(Balinsky, 1981) 망상어 Ditrema temmincki (Lee et al., 1995), 불볼락 Sebastes thompsoni (Lee et al., 1998), 날개망둑 Favonigobius gymnauchen (Lee et al., 2000a), 참서대 Cynoglossus joyneri (Lee et al., 2000b) 등의 일부에서만 보고되었다. 갈치의 난모세포 발달과정 중 여포세포층 및 방사대 발달 그리고 난황핵과 인이 관찰되는 것으로 보아 갈치 난모세포의 난황축적은 대부분의 경골어류와 마찬가지로 외재적 난황축적과 내재적 난황축적 두 가지로 생각된다. 하지만 이에 관한 세부적인 정보를 추가하기 위해서는 추후 전자현미경 및 면역조직화학법과 같은 다양한 연구를 수행할 필요가 있다.
- References
-
-
2. Beams HW, Sekhon SS. 1966. Electron microscope studies on the oocyte of the fresh-water mussel (Anodonta), with special reference to the stalk and mechanism of yolk deposition. J Morphol 119: 477-502.
-
3. Eloryduy-Garay JF, Ramirez-Luna S. 1994. Gonadal development and spawning of female ocean whitefish, Caulolatilus princeps (Pisces: Branchiostegidae) in the Bay of La Paz, B.C.S., Mexico. J Fish Biol 44: 553-566.
-
4. Gosling E. 2003. Bivalve molluscs: Biology, Ecology and Culture. Blackwell Publishing, Oxford, pp 443.
-
5. Kim H, Kim HJ, Kim YS, Lee JS. 2020. Microstructural differentiation of the oocyte in the abalone Haliotis discus hannai. Korean J Fish Aquat Sci 53: 90-97.
-
6. Lee JS, An CM, Chin P. 1995. Sexual maturation of viviparous teleost surfperch, Ditrema temmincki. Korean J Ichthyol 7: 150-159.
-
7. Lee JS, An CM, Huh SH. 1998. Reproductive cycle of the goldeye rockfish, Sebastes thompsoni (Teleostei: Scorpaenidae). Korean J Fish Aquat Sci 31: 8-16.
-
8. Lee JS, Huh SH. 2000. Reproductive biology of the slimy, Leiog- nathus nuchalis (Teleostei: Leiognathidae). Korean J Ichthyol 12: 192-202.
-
9. Lee JS, Kim JW, Kang JC, Shin YK, Chin P. 2000a. Reproductive cycle and gonadal development of the naked-headed goby, Favonigobius gymnauchen (Teleostei: Gobiidae). Korean J Fish Aquat Sci 33: 219-224.
-
10. Lee JS, Kim SY, Ma KH, Huh SH. 2000b. Ovarian development and reproductive cycle of the female red tongue sole, Cynoglossus joyneri (Teleostei: Cynoglossidae). J Kor Fish Soc 33: 554-558.
-
11. Ministry of Oceans and Fisheries. 2022. Fishery Production Servey. https://www.mof.go.kr/statPortal/cate/statView.do
-
12. Sawaguchi S, Kagawa H, Ohkubo N, Hiramatsu N, Sullivan CV, Matsubara T. 2006. Molecular characterization of three forms of vitellogenin and their yolk protein products during oocyte growth and maturation in red seabream (Pagrus major), a marine teleost spawning pelagic eggs. Mol Reprod Dev 73: 719-736.
-
13. Wallace RA, Selman K. 1981. Cellular and dynamic aspects of oocyte growth in teleosts. Am Zool 21: 325-343.