JMLS 2023 December;8(2):178-185. 10.23005/ksmls.2023.8.2.178 Epub 2023 December 17
Copyright © 2023 by The Korean Society of Marine Life Science
Microscopic Anatomy of Male Reproductive Organ in the Long Arm Octopus Octopus minor (Cephalopoda: Octopodidae)
Seong Jin Kim; Department of Aqualife Medicine, Chonnam National University, Yeosu 59626, Korea
Hyeon Jin Kim; Department of Aqualife Medicine, Chonnam National University, Yeosu 59626, Korea
So Ryung Shin; Department of Aqualife Medicine, Chonnam National University, Yeosu 59626, Korea
Myeong Gyo Seo; Department of Aqualife Medicine, Chonnam National University, Yeosu 59626, Korea
Pyeong Woo Kim; Department of Aqualife Medicine, Chonnam National University, Yeosu 59626, Korea
Eun Ha Kim; Department of Aqualife Medicine, Chonnam National University, Yeosu 59626, Korea
Jung Sick Lee; Department of Aqualife Medicine, Chonnam National University, Yeosu 59626, Korea
- Abstract
본 연구는 낙지의 생식생태 이해에 필요한 수컷 생식기관과 정포의 미세해부학적 구조를 기재하였다. 낙지는 교접완의 유무를 통하여 성을 구별할 수 있는 성적이형을 갖는 종이다. 수컷 생식기관은 정소, 일차수정관, 저정낭, 이차수정관, 정포선, 정포낭으로 구성된다. 정소는 조직학적으로 정세관형이었으며, 수컷 생식세포들은 층상배열상을 보였다. 일차수정관은 정소와 저정낭을 연결하는 관으로 상피층과 결합조직으로 이루어져 있었다. 저정낭은 일차수정관과 이차수정관의 사이에 위치하며, 상피층은 상피세포와 점액세포로 구성된다. 점액세포는 AB-PAS (pH 2.5) 반응에서 푸른색, AF-AB (pH 2.5) 반응에서 보라색으로 반응하였다. 이차수정관은 저정낭과 정포선을 연결하는 짧은 관으로 내강에 주름이 발달하였다. 정포선은 다수의 관상선으로 이루어져 있었으며, 분비세포는 호산성 과립을 가지고 있었다. 정포낭은 주머니 모양으로 내강에 주름이 발달하였으며, 상피층에 공포상의 분비세포가 존재하였다. 정포는 길이 약 83.5 mm로 전방부의 당김사, 중간부의 발사체와 고정체, 후방부의 정자 저장부로 구성되어 있었다.
This study was described the microscopic anatomy of male reproductive organs and spermatophore necessary for understanding the reproductive ecology of the long arm octopus Octopus minor. The long arm octopus was a species that has sexual dimorphism that can distinguish between sex based on the presence of hectocotylus. Male reproductive organs consisted of testis, primary spermatic duct, spermatic gland, secondary spermatic duct, spermatophoric gland and spermatophoric sac. Histologically, the testis was testicular tubule type and male germ cells showed a layered arrangement. The primary spermatic duct was a tube connecting the testis and spermatic gland, and consisted with epithelial layer and connective tissue. The spermatic gland was located between the primary and secondary spermatic duct, and the epithelial layer was composed of epithelial cells and mucous cells. Mucous cells reacted blue in the AB-PAS (pH 2.5) reaction and purple in the AF-AB (pH 2.5) reaction. The secondary spermatic duct was a short tube connecting spermatic gland and spermatophoric gland, and folds were developed in lumen. The spermatophoric gland consisted of numerous tubular glands and secretory cells had eosinophilic granules. The spermatophoric sac was shape of pouch, folds were developed in lumen, and vacuolar secretory cells were present in the epithelial layer. The spermatophore was 83.5 mm long and consisted of cap thread in anterior portion, ejaculatory apparatus and cement body in medial portion, sperm mass in posterior portion.x
Keywords: Octopus minor(낙지) Male(수컷) Reproductive organ(생식기관) Sexual dimorphism(성적이형) Spermatophore(정포)
Correspondence to: Jung Sick Lee; Department of Aqualife Medicine, Chonnam National University, Yeosu 59626, Korea
- Received
- 24 November 2023;
- Revised
- 28 November 2023;
- Accepted
- 2 December 2023.
This is an Open Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Language: Korean/English,
Full Text:

서 론
낙지 Octopus minor는 문어목(Octopoda), 문어과(Octopodidae)에 속하는 두족류로서 해양생태계 내에서 먹이사슬의 중간단계로 에너지 전달자 역할을 한다(Kim and Kim, 2007). 한국, 일본 및 중국에 분포하며(Jereb et al., 2016), 조간대 하부부터 수심 약 100 m 범위의 다양한 저질에 서식한다(Kwak et al., 2020).
동물의 수정은 수정장소에 따라서 체외수정과 체내수정으로 구분된다. 많은 수서동물들은 체외수정을 하지만, 갑각류와 두족류 그리고 일부 경골어류 등은 체내수정을 하는 것으로 알려져 있다. 체내수정 과정에서 정자는 대부분 현탁액의 형태로 암컷에게 전달되지만, 일부 갑각류(Scanabissi and Mondini, 2000)와 인상어 Neoditrema ransonneti (Lee et al., 2001) 그리고 대부분의 두족류(Marian, 2015)는 정포(spermatophore)의 형태로 정자를 전달한다.
두족류 수컷은 정자형성, 정포형성, 정포저장 및 전달 등의 특징적인 생식생태적 기능을 수행하기 위하여 매우 분화된 생식기관을 가진다(Mann, 1984; Shin and Lee, 2023). 문어류의 수컷 생식기관에 관한 연구는 O. dofleini maritini (Mann et al., 1970), O. hubbsorum (García-Flores et al., 2019) 등에서 보고되어 있다.
하지만 낙지 수컷 생식기관의 미세해부학적 구조에 관한 연구는 찾아보기 힘들다. 따라서 본 연구는 낙지 수컷의 생식기관과 정포의 구조를 통해 생식생태 이해에 필요한 생물학적 기초자료를 제공하고자 하였다.
재료 및 방법
1. 재료
본 연구에서 사용한 낙지 Octopus minor는 한국 남해안의 보성과 신안 인근에서 2022년 5월부터 7월까지 통발을 통해 채집된 전중 138.3 (± 64.4) g 크기의 20개체를 사용하였다.
2. 방법
2.1. 해부학적 기재
낙지의 외부 형태와 교접완 그리고 외투강 기관계의 위치와 형태를 해부현미경과 이미지 촬영을 통하여 기재하였다.
2.2. 조직학적 분석
수컷의 생식기관을 적출하여 10% neutral formalin에 24시간 고정하였다. 고정된 조직을 24시간 동안 흐르는 물에 수세한 후 ethanol의 농도를 70%부터 100%까지 단계적 탈수를 진행하였다. 이후 paraplast (Leica, Germany)에 4시간 동안 침투시켰다. 침투 후 paraffin에 포매하여 microtome (RM2235, Leica, Germany)을 사용하여 두께 4~5 μm로 연속절편을 제작하였다. 조직표본은 Mayer's hematoxylin-0.5% eosin (H-E) 이중염색, Masson 삼중염색, alcian blue-periodic acid and Schiff's solution (AB-PAS, pH 2.5) 반응, aldehyde fuchsin-alcian blue (AF-AB, pH 2.5) 반응을 실시하였다.
결과 및 고찰
1. 외형 및 성적이형
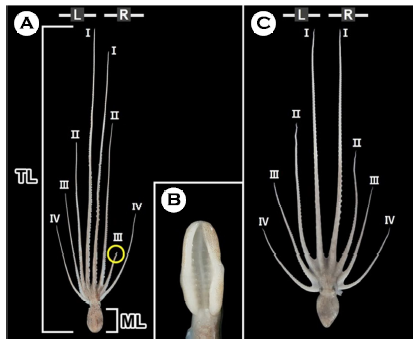
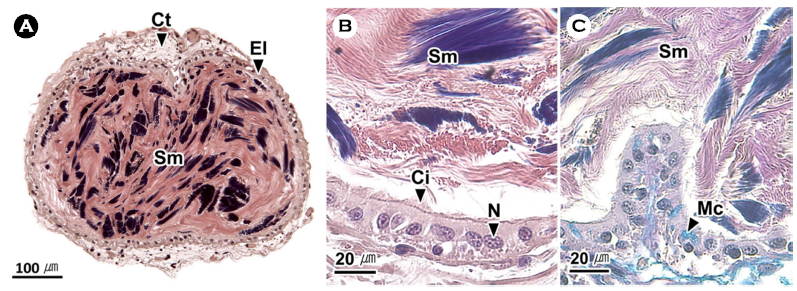
낙지는 여덟 개의 팔 가운데 좌, 우 첫 번째 팔이 가장 길며 바깥쪽으로 갈수록 짧아졌다. 낙지는 성적이형을 갖는 종으로 수컷의 우측 세 번째 팔은 교접완(hectocotylus)으로 암컷의 우측 세 번째 팔에 비해 길이가 짧다(Fig. 1A, C). 교접완의 말단부에 위치한 정포 전달 기구인 교미기(ligula)는 흡반이 없는 긴 스푼 형태였다(Fig. 1B).
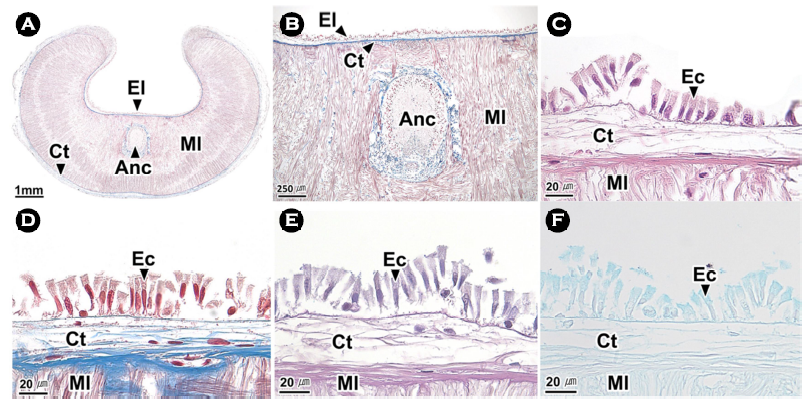
교미기는 조직학적으로 외부로부터 상피층, 결합조직층, 근육층으로 구성되어 있었다(Fig. 2A, B). 상피층은 원주형 상피세포들로 이루어져 있었으며(Fig. 2C-F), 결합조직층은 Masson 삼중염색에서 푸르게 염색되는 콜라겐 섬유로 구성되었다(Fig. 2C). 근육층을 구성하는 근섬유들은 가로와 세로 방향으로 배열되어 있었으며, 근육층의 중앙에는 신경삭이 분포하고 있었다(Fig. 2B).
교접완은 두족류에서 볼 수 있는 대표적인 성적이형으로 종에 따라 다양한 형태를 보이며 정포를 암컷에게 전달하는 역할을 하는 것으로 알려져 있다(Mann, 1984; Hanlon and Messenger, 2018). 문어류인 O. bimaculoides와 O. hubbsorum은 낙지와 동일한 위치에 한 개의 교접완을 갖는다(Stockopf and Oppenheim, 1996; García-Flores et al., 2019). 반면 오징어류인 Idiosepius biserialis, I. notoides, I. paradoxus, I. picteti, I. pygmaeus, I. thailandicus는 좌우 한 개씩, 모두 두 개의 교접완을 갖는다(von Byern and Klepal, 2010).
2. 해부학적 구조
외투강 기관계는 중앙에 갈색의 소화선을 중심으로 좌우 양쪽에 한 쌍의 아가미가 위치하였고 아가미 아래에 아가미심장(branchial heart)과 신장이 있었으며, 정소는 가장 하부에 위치하였다(Fig. 3A).
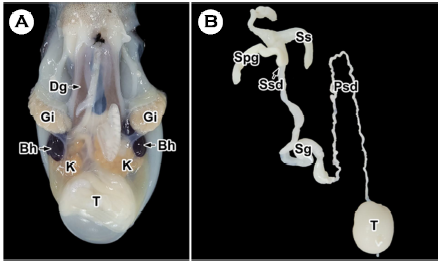
Fig. 3. Anatomy (A) and male reproductive system (B) of the long arm octopus Octopus minor. Bh: branchial heart, Dg: digestive gland, Gi: gill, K: kidney, Psd: primary spermatic duct, Sg: spermatic gland, Spg: spermatophoric gland, Ss: spermatophoric sac, Ssd: secondary spermatic duct, T: testis.
수컷의 생식기관은 정소(testis), 일차수정관(primary spermatic duct), 저정낭(spermatic gland), 이차수정관(secondary spermatic duct), 정포선(spermatophoric gland) 그리고 정포낭(spermato- phoric sac)의 순서로 구성되었다(Fig. 3B). 정소는 유백색의 구형으로 외투강 기관계의 가장 하단에 위치하며 일차수정관과 연결되어 있었다. 일차수정관은 정소와 저정낭 사이에서 엉킨 실타래 모양으로 길게 풀면 구불구불한 관 형태였다. 저정낭은 일차수정관과 이차수정관을 연결하는 팽창된 관 형태로 반투명하여 내강에 코일 형태의 정자 덩어리가 관찰되었다. 이차수정관은 저정낭과 정포선을 연결하는 얇은 관 형태였다. 정포선은 불투명한 맹낭 형태였다. 정포낭은 반투명한 주머니 형태로 내강에서는 정포들이 관찰되었다(Fig. 3B).
3. 정소
낙지의 정소는 다수의 세관들로 구성된 정세관형이었으며, 정세관은 얇은 결합조직으로 구성되어 있었다(Fig. 4A, B). 생식세포들은 정세관의 가장자리부터 정원세포, 정모세포, 정세포, 정자 순서로 층상배열상을 보였다(Fig. 4C). 정원세포는 원형으로 핵이 세포의 대부분을 차지하며 H-E 염색에서 핵은 보라색, 세포질은 연보라색으로 나타났다. 정모세포는 정원세포보다 핵이 응축되어 진한 염색성을 보였다. 정세포는 세포의 형태가 타원형으로 변화하며 H-E 염색에서 호염기성을 보였다. 정자는 정세관 내강에서 주로 관찰되었으며, H-E 염색에서 두부는 푸른색의 가늘고 긴 형태로 나타났고, 꼬리는 붉은색의 가는 실 형태로 나타났다(Fig. 4C).
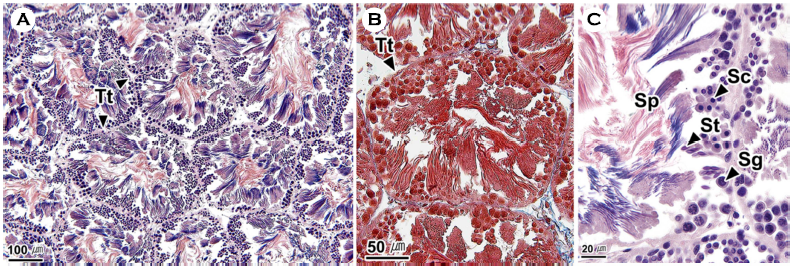
낙지의 정소는 정세관형 및 생식세포의 층상배열 구조에서 문어속의 O. rubescens 및 O. hubbsorum과 유사하였다(López-Peraza et al., 2013; García-Flores et al., 2019).
4. 일차수정관
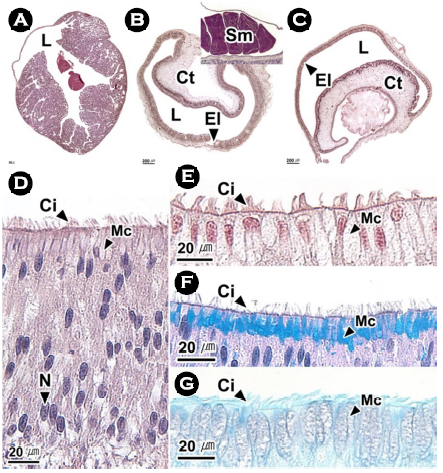
일차수정관은 상피층과 얇은 결합조직층으로 구성되어 있었으며(Fig. 5A), 상피층은 단층으로 섬모원주상피세포와 AB-PAS (pH 2.5) 반응에서 푸르게 나타나는 점액세포들로 구성되어 있었다(Fig. 5B, C).
일차수정관은 proximal vas deferens (Peterson, 1959; Mann et al., 1970; Stoskopf and Oppenheim, 1996), spermatic duct (López-Peraza et al., 2013), spermatophoric duct (García-Flores et al., 2019)라는 명칭으로 다양하게 보고되었다. 낙지의 일차수정관 상피층에서는 점액세포가 관찰되었으나 O. rubescens와 O. hubbsorum의 일차수정관에서는 점액세포가 보고되지 않았다(López-Peraza et al., 2013; García-Flores et al., 2019). 낙지에서 정자는 일차수정관을 통과하며 정자 덩어리를 형성하는데 이는 문어속의 참문어 O. vulgaris, O. rubescens, O. hubbsorum와 유사하였다(Mann, 1984; López-Peraza et al., 2013; García-Flores et al., 2019).
5. 저정낭
저정낭의 전방부는 부풀어 오른 모양이었으며, 조직학적으로 다수의 관상선으로 이루어져 있었다(Fig. 6A). 중간부(Fig. 6B)와 후방부(Fig. 6C)는 관 형태로 내강은 말발굽 모양이었으며, 조직학적으로 상피층과 결합조직층으로 이루어져 있었다. 내강에서는 외막이 형성되지 않은 정자 덩어리들이 관찰되었다(Fig. 6B). 중간부와 후방부의 상피층은 단층으로 섬모원주상피세포와 점액세포가 존재하였다. 점액세포는 H-E 염색과 Masson 삼중염색에서 공포상으로 나타났다(Fig. 6D, E). 또한 세포질 상부에 AB-PAS (pH 2.5) 반응에서 푸른색, AF-AB (pH 2.5) 반응에서 보라색으로 관찰되는 점액물질을 가지고 있었다(Fig. 6F, G).
Peterson (1959)은 저정낭을 mucilaginous gland와 spermato- phoric forming duct로 구분하였고 López-Peraza et al. (2013)은 spermatophoric gland를 위치에 따라 근위부(proximal portion)와 원위부(distal portion)로 구분하였다. 저정낭을 구분하지 않은 경우에는 spermatophoric gland sysytem Ⅰ (seminal vesicle) (Mann et al., 1970), first spermatophoric gland (Stoskopf and Oppenheim, 1996), spermatophoric gland (García-Flores et al., 2019)라고 보고하였다. O. rubescens와 O. hubbsorum의 저정낭의 상피층은 위중층으로 섬모원주상피세포로 구성되어 있다(López-Peraza et al., 2013; García-Flores et al., 2019). O. dofleini martini에서 저정낭은 정자 덩어리를 코일 형태로 만들고 정포의 발사체(ejaculatory apparatus)를 형성하는 물질을 분비한다. 분비물질은 젤 형태로 정자 덩어리의 후방에 부착되어 함께 정포선으로 이동된다(Mann et al., 1970).
6. 이차수정관
이차수정관의 내강에는 다수의 주름이 존재하였으며(Fig. 7A), 주름은 단층의 섬모원주상피세포와 Masson 삼중염색에서 푸른색과 붉은색으로 반응하는 섬유성근육층으로 이루어져 있었다(Fig. 7B, C). 상피세포의 핵은 주로 상부에 위치하였고 자유면의 섬모는 H-E 염색과 Masson 삼중염색에서 붉은색, AB-PAS (pH 2.5) 반응에서 보라색, AF-AB (pH 2.5) 반응에서 푸르게 나타났다(Fig. 7B-E).
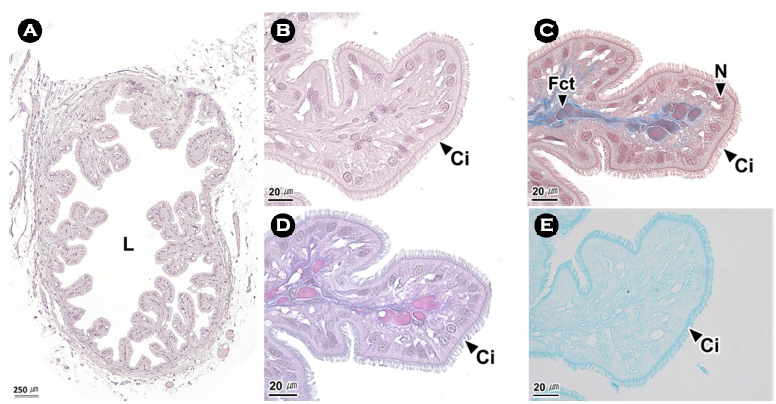
수정관에 대해서 Mann et al. (1970), Peterson (1959), Stockopf and Oppenheim (1996)은 위치에 따라서 근위수정관(proximal vas deferens)과 원위수정관(distal vas deferens, vas deferens distale)으로 보고하였다.
7. 정포선
정포선은 다수의 관상선으로 구성되며(Fig. 8A, B), 분비세포는 세포질 상부에 과립이 발달되어 있었다. 이들 과립은 H-E 염색과 Masson 삼중염색에서 붉은색, AB-PAS (pH 2.5) 반응에서 자주색, AF-AB (pH 2.5) 반응에서 회색으로 나타났다(Fig. 8B-E). 정포선에서 관찰되는 정포의 고정체(cement body)는 외부에 삼중막을 가지며, 내부는 점액물질로 채워져 있었다. 삼중막은 모두 H-E 염색에서 붉은색, Masson 삼중염색에서 푸른색으로 반응하였다. 반면 AB-PAS (pH 2.5) 반응에서 외막은 보라색, 중간막과 내막은 푸른색으로 나타났다. 점액물질은 H-E 염색과 Masson 삼중염색에서 붉은색, AB-PAS (pH 2.5) 반응에서 보라색으로 나타났다(Fig. 8F-H). 정자 덩어리는 한 개의 외막에 둘러싸여 있었다. 외막은 H-E 염색에서 붉은색, Masson 삼중염색에서 푸른색, AB-PAS (pH 2.5) 반응에서 보라색으로 나타났다(Fig. 8I-K).
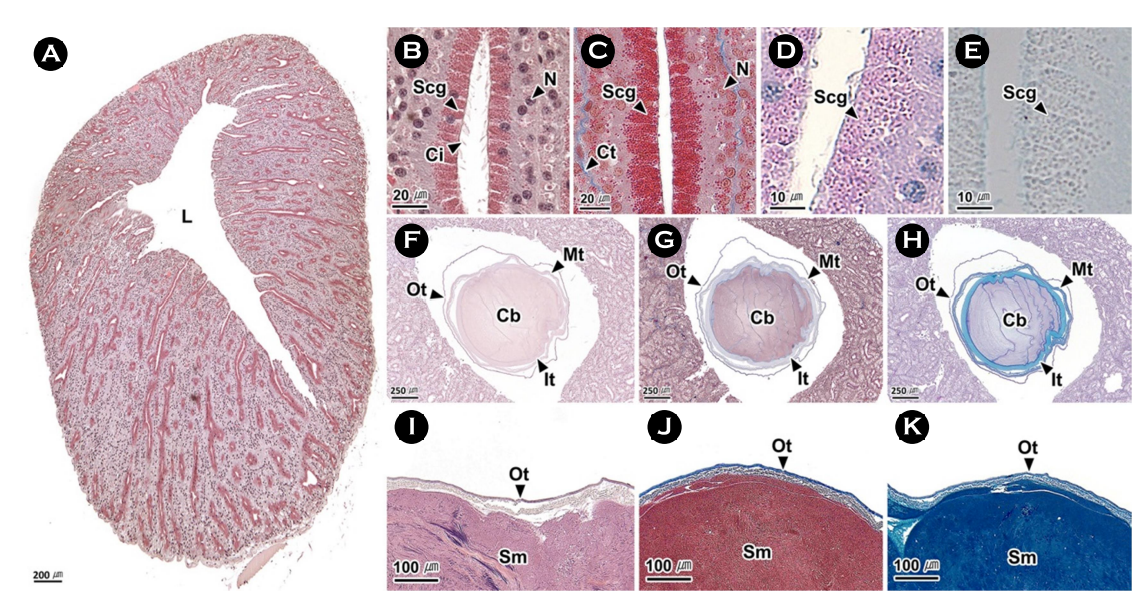
정포선은 연구자에 따라 accessory gland (Peterson, 1959), sper- matophoric gland system Ⅱ (prostate) (Mann et al., 1970), second spermatophoric gland (Stoskopf and Oppenheim, 1996), accessory spermatic gland (López-Peraza et al., 2013), spermatophoric gland (García-Flores et al., 2019)로 보고되었다. 문어속의 O. rubescens와 O. hubbsorum의 정포선은 관상선 구조로 낙지와 유사한 조직학적 구조를 보였다(López-Peraza et al., 2013; García-Flores et al., 2019). Mann (1984)은 정포선에서 만들어진 코일 형태의 정자 덩어리와 발사체 및 고정체의 구성물질은 정포선을 통해 정형화되며 분비물질이 추가되어 완전한 정포를 형성한다고 보고하였다. 본 연구에서 정포선의 분비과립과 정포막의 염색성의 차이를 보였는데, 이에 관해서는 추후 연구가 필요하다.
8. 정포낭
정포낭의 내강에는 다수의 분지형 주름들이 분포하였으며, 내강에서는 정포를 관찰할 수 있었다(Fig. 9A). 정포낭의 주름은 단층의 상피층과 섬유성근육층으로 구성되며, 상피층에서는 섬모원주상피세포와 분비세포를 구분할 수 있었다(Fig. 9B-D). 분비세포는 H-E 염색, Masson 삼중염색, AB-PAS (pH 2.5) 반응에서 불투명한 공포상으로 나타났다(Fig. 9B-D).
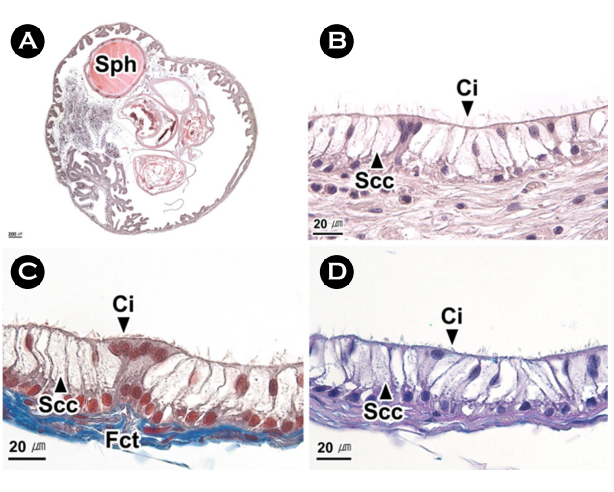
선행연구에서 정포낭은 spermatophoric sac (Mann et al., 1970)과 Needham's sac (Peterson, 1959; Stoskopf and Oppenheim, 1996; López-Peraza et al., 2013; García-Flores et al., 2019)이 혼용되어 사용되었다. 정포낭의 조직학적 구조는 종에 따라 차이를 보이는데, O. bimaculoides의 정포낭은 단층의 섬모입방상피층과 결합조직으로 구성되며(Peterson, 1959), O. hubbsorum에서는 위중층의 섬모원주상피층과 결합조직층으로 구성된다(García-Flores et al., 2019).
9. 정포
정포는 길이 약 83.5 mm로 당김사(cap thread)가 위치한 전방부, 발사체와 고정체로 구성된 중간부 그리고 정자 저장부인 후방부로 구분할 수 있었다(Fig. 10A). 당김사의 길이는 약 35. 1 mm로 얇은 실 모양이었다. 발사체와 고정체는 약 21.3 mm로 내부에 투명한 물질이 충만하였다. 조직학적으로 외막, 중간막, 내막의 삼중막으로 둘러싸여 있었다. 외막과 중간막은 H-E 염색과 Masson 삼중염색에서 붉은색, AB-PAS (pH 2.5) 반응에서 보라색으로 나타났다. 반면 내막은 다른 막들과 비교하여 약한 염색성을 보였다(Fig. 10B-D). 막과 막 사이 공간은 AB-PAS (pH 2.5) 반응에서 푸르게 나타나는 점액물질로 채워져 있었다(Fig. 10D). 정자 저장부는 약 27.5 mm로 내부에 코일 형태의 정자 덩어리가 존재하였다(Fig. 10A). 조직학적으로 한 개의 외막에 둘러싸여 있었으며, 외막은 H-E 염색에서 붉은색, Masson 삼중염색에서 푸른색, AB-PAS (pH 2.5) 반응에서 보라색으로 나타났다(Fig. 10E-G).
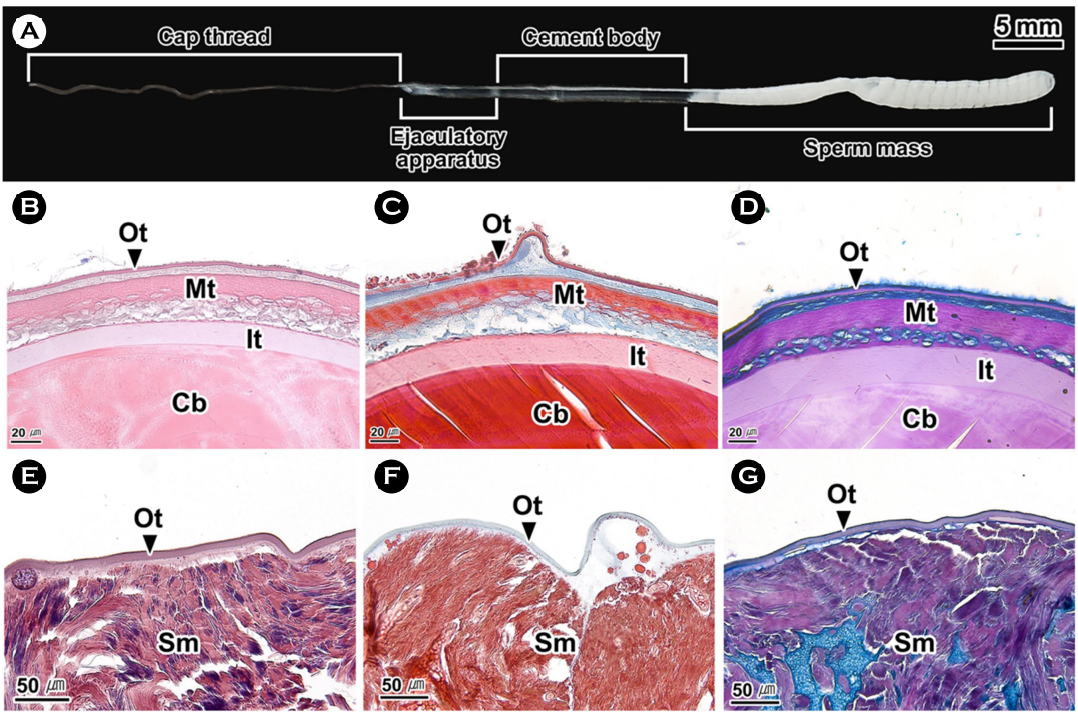
문어류에서 교접완은 정포를 암컷에게 전달하고(Mann, 1963) 암컷에게 전달된 정자는 암컷의 생식기관 내부에 수정 전까지 보관된다(Wodinsky, 2008; Hanlon and Messenger, 2018). 정포는 정자를 암컷의 생식기관으로 전달하는 과정에서 정자를 고밀도로 유지시키기 위한 방법으로 알려져 있다(Ginzburg, 1972). O. dofleini martini의 정포 구조는 낙지와 유사하였다(Hanson et al., 1973). 팔완류의 정포 길이는 참문어 O. vulgaris에서는 2~3 cm (Wells, 2013), Elendone moschata에서는 8 mm, E. cirrhosa에서는 15 mm (Hanlon and Messenger, 2018), O. hubbsorum에서는 3.97 cm (García-Flores et al., 2019)로 종에 따라 다양하게 나타났다. 낙지 정포의 정자 저장부는 한 개의 외막에 둘러싸여 있었는데 이는 O. hubbsorum과 유사하였다. 하지만 고정체의 막 구조에서 낙지는 삼중막이었지만, O. hubbsorum에서는 이중막으로 차이가 있었다(García-Flores et al., 2019).
- References
-
1. García-Flores M, Aguilar-Cruz CA, Arellano-Martínez M, Ceballos-Vázquez BP. 2019. Morphological and histological description of the reproductive system of Octopus hubbsorum (Mollusca: Cephalopoda). Invertebr Reprod Dev 63: 268-281.
-
2. Ginzburg AS. 1972. The spermatozoon. Detlaf TA (ed.), Fertilization in Fishes and the Problem of Polyspermy. Acad Sci USSR, Moscow, pp 87-145.
-
3. Hanlon RT, Messenger JB. 2018. Reproductive behaviour. Hanlon RT, Messenger JB (ed.), Cephalopod Behaviour. Cambridge University Press, Cambridge, pp 148-205.
-
4. Hanson D, Mann T, Martin AW. 1973. Mechanism of the sper- matophoric reaction in the giant octopus of the North Pacific, Octopus dofleini martini. J Exp Biol 58: 711-723.
-
5. Jereb P, Roper CFE, Norman MD, Finn JK. 2016. Cephalopods of the world. Vol. 3. FAO, Rome, pp 200-201.
-
-
7. Kwak SN, Kim SS, Lee KS, Jung SM, Kang JM. 2020. Feeding ecology of Octopus minor in the mud flat. J Kor Soc Fish Mar Edu 32: 665-672.
-
8. Lee JS, Jeong SY, Chung EY. 2001. Formation and structure of the spermatozeugmata of Neoditrema ransonneti (Perciformes: Embiotocidae). Dev Reprod 5: 145-150.
-
9. López-Peraza DJ, Hernández-Rodríguez M, Barón-Sevilla B, Bückle-Ramirez LF. 2013. Histological analysis of the reproductive system and gonad maturity of Octopus rubescens. Int J Morphol 31: 1459-1469.
-
10. Mann T. 1963. 5-Hydroxytryptamine in the spermatophoric sac of the octopus. Nature 199: 1066-1067.
-
11. Mann T. 1984. Mollusca. Heinrich B, Johansen K, Langer H, Neuweiler G, Randall DG (ed.), Spermotophores: Development, Structure, Biochemical Attributes and Role in the Transfer of Spermatozoa. Springer, Berlin, pp 18-71.
-
12. Mann T, Martin AW, Thiersch JB. 1970. Male reproductive tract, spermatophores and spermatophoric reaction in the giant octopus of the North Pacific, Octopus dofleini martini. Proc R Soc Lond Ser B 175: 31-61.
-
13. Marian JEAR. 2015. Evolution of spermatophore transfer mech- anisms in cephalopods. J Nat Hist 49: 1423-1455.
-
14. Peterson RP. 1959. The anatomy and histology of the reproductive of Octopus bimaculoides. J Morphol 104: 61-87.
-
15. Scanabissi F, Mondini C. 2000. Sperm transfer and occurrence of spermatophore in the Conchostraca Leptestheriidae (Crus- tacea, Branchiopoda). Invertebr Reprod Dev 38: 99-106.
-
16. Shin SR, Lee JS. 2023. Microanatomical structure of male repro- ductive organ in the common squid, Todarodes pacificus (Cephalopoda: Ommastrephidae). J Mar Life Sci 8: 1-7.
-
17. Stoskopf MK, Oppenheim BS. 1996. Anatomic features of Octopus bimaculoides and Octopus digueti. J Zoo Wildl Med 27: 1-18.
-
18. von Byern J, Klepal W. 2010. Re-evaluation of taxonomic characters of Idiosepius (Cephalopoda, Mollusca). Malacologia 52: 43-65.
-
19. Wells MJ. 2013. Reproduction and growth. Wells MJ (ed.), Octopus: Physiology and Behaviour of an Advanced Invertebrate. Springer, Berlin, pp 82-110.
-
20. Wodinsky J. 2008. Reversal and transfer of spermatophores by Octopus vulgaris and O. hummelincki. Mar Biol 155: 91-103.