JMLS 2023 December;8(2):166-177. 10.23005/ksmls.2023.8.2.166 Epub 2023 December 17
Copyright © 2023 by The Korean Society of Marine Life Science
Effects of Korean Goldenbell (Forsythia koreana) Leaf on the Growth, Body Color and Hepatopancreatic Structure of Giant Freshwater Prawn (Macrobrachium rosenbergii)
Dong Woo Kim; Sunmoon University, Department of Aquatic Life and Medical Science, Asan 31460, Korea
Jeong Hee Yoon; Sunmoon University, Department of Aquatic Life and Medical Science, Asan 31460, Korea
Ji Eun Ha; Sunmoon University, Department of Aquatic Life and Medical Science, Asan 31460, Korea
Jeong Hee Min; Sunmoon University, Department of Aquatic Life and Medical Science, Asan 31460, Korea
Bo Ryung Park; Sunmoon University, Department of Aquatic Life and Medical Science, Asan 31460, Korea
Joon Yeong Kwon; Sunmoon University, Department of Aquatic Life and Medical Science, Asan 31460, Korea
- Abstract
큰징거미새우(Macrobrachium rosenbergii)는 양식 시설 내에서 체색 불량 및 갑각 약화와 같은 문제로 경제적 손실을 겪고 있다. 이 종은 동물성 원료 기반의 사료로 양식되지만, 야생에서는 식물체 비중이 높은 detritus를 주로 섭취한다. 새우가 야생에서 섭취한 식물체는 기본 영양소뿐만 아니라 체색의 재료인 카로티노이드의 공급원이기도 하다. 개나리(Forsythia koreana)는 우리나라에 널리 분포하는 꽃나무로 잎에는 황색 당근에 버금가는 양의 카로티노이드가 함유되어 있다. 본 연구에서는 큰징거미새우에게 개나리 잎을 공급하여 체색 및 건강도에 미치는 효과를 조사하였다. 실험사료는 「배합사료 100%(대조구), CON」, 「배합사료 80%+개나리 잎 분말 20%, FP」, 「배합사료 80%+가공하지 않은 개나리 잎 20%, FL」의 세 가지였으며, 각 조건의 사료를 평균 체중 1.1 ± 0.2 g의 어린 새우들에게 10주간 공급하였다. 실험 결과, 체색의 경우, CON의 새우들은 일관적으로 투명한 상아색을 띠었으나, FP와 FL 새우의 경우 사육일의 경과에 따라 푸른색을 거쳐 암갈색으로 변화하였다. 생존과 성장은 CON과 FP 또는 FL 사이에 유의한 차이가 없었다. 간췌장을 조직학적으로 비교한 결과, hepatopancreatic tubule의 구성 세포 중 B cell의 vacuole 크기가 CON에 비해 FP과 FL에서 훨씬 컸다. B cell의 vacuole은 영양소의 흡수 및 소화의 역할을 하며, 개나리 잎의 공급이 큰징거미새우의 건강에 긍정적으로 작용했을 가능성을 시사한다. 이상의 결과는 큰징거미새우의 양식에 개나리 잎을 활용하면 성장 저해 없이 체색의 개선 및 건강도의 향상을 기대할 수 있음을 보여준다.
The giant freshwater prawn (Macrobrachium rosenbergii) suffers economic losses in aquaculture facilities due to problems such as poor body color and carapace weakness. While this species is farmed on an animal-based diet, in the wild it consumes a detritus diet with a high proportion of plant matter. The plant matter they consume in the wild is not only a source of basic nutrients, but also carotenoids, which are responsible for body color. Korean goldenbell (Forsythia koreana) is a flowering tree widely distributed in Korea, and its leaves contain carotenoids comparable to yellow carrots. In this study, we investigated the effects of feeding Forsythia leaves to M. rosenbergii on their body color and health. The experimental diets were 100% commercial feed (control), CON, 80% commercial feed plus 20% Forsythia leaf powder, FP, and 80% commercial feed plus 20% unprocessed Forsythia leaves, FL, and each diet was fed to juvenile prawn with an average weight of 1.1 ± 0.2 g for 10 weeks. In terms of body color, the CON prawn were consistently clear ivory in color, while the FP and FL prawn changed from blue to dark brown as the days of rearing progressed. Survival and growth were not significantly different between CON and FP or FL. Histological comparison of the hepatopancreas revealed that the vacuole size of B cells, the constituent cells of the hepatopancreatic tubule, was significantly larger in FP and FL compared to CON. The vacuoles of B cells are responsible for the absorption and digestion of nutrients, suggesting that the supply of Forsythia leaves may have had a positive effect on the health of the M. rosenbergii. The above results show that the use of Forsythia leaves in the aquaculture of M. rosenbergii can be expected to improve body color and health without inhibiting growth.
Keywords: Macrobrachium rosenbergii(큰징거미새우) Forsythia koreana(개나리) Body color(체색) Hepatopancreas(간췌장) Carotenoids(카로티노이드)
Correspondence to: Joon Yeong Kwon; Sunmoon University, Department of Aquatic Life and Medical Science, Asan 31460, Korea
- Received
- 20 November 2023;
- Revised
- 24 November 2023;
- Accepted
- 30 November 2023.
This is an Open Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Language: Korean/English,
Full Text:

서 론
큰징거미새우(Macrobrachium rosenbergii)는 동남아시아 지역과 중국을 포함한 세계 30개 이상의 국가에서 생산되는 중요한 내수면 양식품종이다(New, 2002). 이 종은 질병에 대한 내성이 크고 성장 속도가 빨라(Ranjeet and Kurup, 2002; Hooper et al., 2023), 양식 생산량이 지속적으로 증가하였으며, 2020년에는 전 세계 생산량이 294,000톤을 넘어섰다(FAO, 2023). 그러나 이러한 양적 팽창에도 불구하고 체색 불량 및 갑각 약화 등과 같은 문제는 여전히 해결해야 할 문제로 남아있다(Harpaz and Schmalbach, 1986; Kumar et al., 2004; Hooper et al., 2023).
큰징거미새우를 포함한 갑각류의 체색 불량은 부적절한 먹이에서 기인되었을 가능성이 높다. 담수산 십각목 갑각류들은 다양한 동 · 식물성 먹이원 및 죽은 동식물의 분해물을 의미하는 부식물(detritus)를 먹이로 활용한다(Vogt, 2019). 적극적인 포식성을 띠는 큰징거미새우의 야생개체군도 이 부식물을 주요 먹이원으로 활용한다(Habashy and Raafat, 2008). 현재 갑각류의 양식은 어분 기반 동물성 사료를 공급하여 이루어지나, 여기에는 야생에서 섭취할 수 있는 식물성 먹이원이 결핍되어 있어 체색이나 건강도에 부정적인 결과를 유발할 수 있다. 선행 연구들은 이러한 문제점들이 식물성 먹이원이나 카로티노이드의 보충으로 개선될 수 있음을 보여주고 있다. 카로티노이드를 함유한 사료는 담수산 가재인 Cherax quadricarinatus 및 Procambarus virginalis의 체색을 개선하였고 갑각의 색소량 증가를 유도하였다(Harpaz et al., 1998; Kaldre et al., 2015). 또한 홍다리얼룩새우(Penaeus monodon) 치하의 사육수조에 맹그로브나무 잎을 투입한 결과, 생존률, 증체량, 사료요구량 및 체색 개선이 확인되었다(Alam et al., 2022). 이와 유사하게, 참게(Eriocheir sinensis)의 성숙한 암컷에게 담수산 녹조류인 Haematococcus pluvialis 분말을 사료에 섞어 공급한 결과 난소, 갑각, 간췌장의 체색 개선과 총 카로티노이드 함량의 증가, 항산화 능력의 향상이 관찰되었다(Long et al., 2017).
이 외에도 식물성 카로티노이드는 갑각류의 체내에서 프로비타민A로의 전환이나 항산화, 광보호와 같이 다양한 역할을 수행하여 생존, 성장 강화, 번식능력 및 스트레스 저항성 향상 등에 기여할 가능성이 다수 보고되었다(Wade et al., 2017). 새우 양식 시 식물성 먹이원의 보충은 그로부터 생성되는 유익균 및 플랑크톤과 복합적으로 작용하여 성장 및 생존률에 긍정적 상승효과를 발휘할 수 있다(Alam et al., 2022). 큰징거미새우에서도 촉각과 각뿔 손상, 갑각 약화, 다리 기형을 초래하는 부속지 기형 증후군(MDS)의 경우 카로티노이드의 충분한 공급으로 치료될 수 있음이 밝혀졌고(Kumar et al., 2004), 참게(E. sinensis)도 천연 카로티노이드 공급으로 항산화 능력과 면역력이 향상되었다(Liu et al., 2020).
그런데 갑각류는 체색의 재료이며 건강에 도움을 주는 카로티노이드를 스스로 생합성 할 수 없으며, 먹이원에 포함된 색소에 의존한다(Goodwin, 1952; Wade et al., 2017). 따라서 갑각류의 양식 시 생산 효율 증진 및 상품성 향상을 위해 먹이에 카로티노이드의 일종인 합성 아스타잔틴을 포함시키는 방법이 시도되고 있다(Stachowiak and Szulc, 2021). 그러나 이 방법의 중요한 결점은 인체 안전성에 대한 우려이다(Brotosudarmo et al., 2020). 합성 아스타잔틴의 부작용이나 잠재적인 독성은 아직 확립되거나 보고된 바 없지만(Lim et al., 2018), 석유화학 공급원으로부터 합성되는 특성상 부반응과 부산물이 혼재하여 사람이 직접 섭취하는 것이 승인되지 않았다(Panis and Carreon, 2016; Kildegaard et al., 2017). 합성 아스타잔틴은 이러한 식품안전(최종 제품의 잠재적 독성), 오염 및 지속 가능성 문제를 내포하여, 수산양식에만 부분적으로 사용이 허용되어 있으며 다른 동물의 사료로 쓰이는 것은 허용되지 않았다(Li et al., 2011). 이와 함께, 합성 아스타잔틴의 사용은 경제적 측면에서도 애로 사항이 존재한다. 체색 개선을 목적으로 합성 아스타잔틴 첨가사료를 이용할 경우, 생산비용을 크게 증가시키게 되는데(Boonyaratpalin et al., 2001), 갑각류 양식의 경우 사료비용의 25~30% 정도를 증가시키는 요인으로 작용한다(Zhang et al., 2021). 따라서 이보다 비용 효율적이고 안전한 체색 개선 방법의 개발이 요구된다.
개나리(Forsythia koreana)는 3~4월에 노란색 꽃을 피우는 식물로 보통 조경수로 이용하고 있지만 한약재로 사용되기도 한다. 개나리의 잎에는 forsythin, forsythoside A, rutin, hyperin, quercetin, triterpene acids, ursolic acid, oleanolic acid와 같은 다양한 생리활성 화합물이 포함되어 있다(Wang et al., 2018b; Zhao et al., 2020). 개나리 잎의 총 카로티노이드 함량에 대해서는 조사된 바가 없으나, 개나리와 유전적으로 가까운 산개나리(F. saxatilis) 잎의 경우 849 μg/g의 총 카로티노이드 함량을 나타내었으며(Han et al., 2011), 개나리와 개나리 원예품종(F. 'Courtaneur')의 교잡 1세대의 경우 300 μg/g의 총 카로티노이드 함량이 확인되었다. 또한 카로티노이드가 많지 않은 원예품종인 수원골드(F. koreana 'Suwon Gold')의 경우도 100 μg/g의 카로티노이드를 함유하고 있어(Wang et al., 2017). 원종 개나리의 잎에는 이보다 많은 카로티노이드계 색소가 함유되어 있음을 추측 가능하다. 한편, 식용작물 중 우수한 카로틴 함량으로 유명한 황색당근의 경우 100 μg/g의 총 카로티노이드 함량을 가진다(Lee et al., 2011). 이러한 수치의 비교는 개나리 잎이 큰징거미새우를 포함한 새우류 양식을 위한 우수한 색소원으로 활용될 수 있음을 시사한다.
본 연구의 대상생물과 동일한 큰징거미새우에게 식물성 먹이원을 보충한 연구를 살펴보면, 개별사육 하의 성체들에게 가죽나무(Ailanthus altissima)와 애기아욱(Malva parviflora)의 생잎을 공급할 경우 흑점병 발병률 감소, 체중 증가, 탈피간격의 단축과 같은 결과를 얻었다(Harpaz and Schmalbach, 1986). 이와 유사하게, 치하를 대상으로 약초의 일종인 Ocimum sanctum, Phyllanthus amarus, Solanum trilobatum를 첨가한 사료를 공급한 결과 생존률, 성장률, 소화효소의 활동 등 긍정적인 효과가 보고되었다(Muralisankar et al., 2018). 따라서 개나리 잎의 공급도 큰징거미새우의 체색 및 건강도 개선에 기여할 가능성이 높다.
갑각류의 체색은 먹이로 섭취한 카로티노이드를 재료로 형성된다(Wade et al., 2017). 충분한 양의 카로티노이드를 섭취한 개체가 종 고유의 최적 체색을 띠며(Wade et al., 2017), 가열 시에도 선명한 적색을 띠게 된다(Amaya and Nickell, 2015; Rodríguez et al., 2017). 반면 충분한 카로티노이드를 섭취하지 못한 개체의 경우는 정상보다 희미한 체색을 띠게 되고(Wade et al., 2015), 가열 시에도 정상보다 연한 색을 띤다(Long et al., 2017; Wang et al., 2018a).
새우 양식과 관련하여 간췌장(hepatopancreas)의 상태는 새우의 건강상태를 반영하는 중요한 지표가 될 수 있다(Prathomya et al., 2019; Setyastuti et al., 2022). 간췌장은 새우 두흉강의 대부분을 차지하는 주요 소화기관으로(Silva et al., 2018), 글리코겐 형태의 소화생성물 저장, 배설물을 통한 잔류물질 제거, 갑각 형성에 필요한 미네랄 저장, 지단백질, 비텔로게닌, 헤모시아닌의 합성, 지방 유화제 합성 및 재활용, 면역 방어 분자 합성 등 다양한 역할을 수행한다(Silva et al., 2018; Vogt, 2019). 이에 따라 간췌장의 조직학적 분석은 새우의 영양 및 건강상태를 파악하는 수단으로 활용된다(Reddy et al., 1999; Fernández Gimenez et al., 2004; Pourmozaffar et al., 2019a).
본 연구에서는 개나리 잎을 공급하여 큰징거미새우의 체색 및 건강도를 개선할 수 있는지 알아보기 위하여 먹이 비교 실험 후 대조구와 처리구 새우 사이의 성장, 생존, 가열 전후의 체색 및 간췌장 조직의 차이를 분석하였다.
재료 및 방법
1. 개나리 잎 준비 및 사료 제작
개나리(F. koreana) 잎을 채취하여 절반은 지퍼백에 담아 영하 20℃에 보관하였고, 나머지 절반은 그늘지고 통풍이 잘 되는 장소에서 더 이상 무게에 변동이 없을 때까지 9일간 건조시켰다. 이 때, 잎의 건조 전 무게와 건조 후 무게를 측정하여 습중량과 건중량의 차이를 파악하였다. 건조된 잎은 곡물용 제분기(Huangdai, 800 Y)를 사용해 제분한 후 양식새우용 미립자사료(우성사료, 대하플러스 스타트)와 섞어 사료를 제작하였다. 사료 배합비는 개나리 잎 분말 100 g (20%), 밀글루텐 35 g (7%), 양식새우용 미립자사료 360 g (72%) 그리고 제빵용 이스트 5 g (1%)이었으며, 여기에 물 300 mL을 부어 30분간 반죽하였다. 이후 수동 펠렛기(Jiaozuo Double Eagle Machinery)를 사용해 직경 약 1.5 mm 크기의 입자로 펠렛화하였다. 이 펠렛은 그늘지고 통풍이 잘 되는 장소에서 더 이상 무게에 변동이 없을 때까지 건조시켜 냉장보관하였다가 개나리 잎 분말 첨가 사료구(Commercial feed, CF 80% + Forsythia powder, FP 20%)의 먹이로 사용하였다. 대조구 사료는 밀글루텐 35 g (7%)과 양식새우용 미립자사료 465 g을 고르게 섞어 제작하였으며 그 외 제조 및 보관 과정은 개나리 잎 분말 첨가 사료의 제작 과정과 동일하였다.
2. 실험동물 및 사육실험
전라북도 수산기술연구소 민물고기연구센터로부터 분양 받은 큰징거미새우 치하를 선문대학교 사육실험실로 수송 후 약 한 달간 순치시키면서 평균 체중 1.1 ± 0.2 g이 될 때까지 길러서 실험에 이용하였다. 큰징거미새우는 개체간 공격성이 심하고 공식이 잦아서 실험용 60 L 수조를 6개의 공간으로 나눈 다음 5개의 공간에 각각의 공간마다 큰징거미새우 치하를 1마리씩 수용하였고, 나머지 1개의 공간에는 여과기와 수중 히터를 설치하였다. 개나리 사료 실험을 위하여 이와 동일한 수조 9개를 제작하여 이용하였다(Fig. 1).
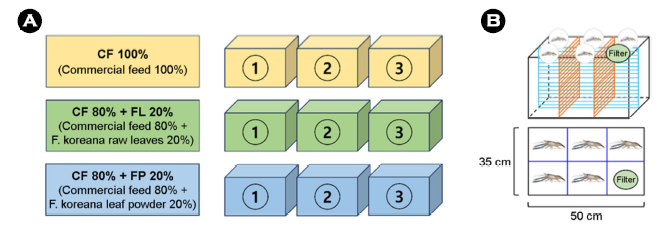
사료 실험구는 대조구(CF 100%, Control: CON), 개나리 잎 분말 첨가 사료구(CF 80% + Forsythia powder 20%, FP), 개나리 생잎 투여구(CF 80% + Forsythia leaf 20%, FL)의 3종류로 구성하였다. 한 실험당 3개의 반복수조를 이용하였고, 각각의 수조당 5마리의 새우를 개별 수용하였다. 따라서 한 그룹당 15마리의 큰징거미새우 치하가 투입되어 총 45마리의 개체로 실험이 진행되었다. 모든 개체는 개체번호를 부여하여 성장 파라미터의 기록에 활용하였다. FAO의 큰징거미새우 양식메뉴얼에 의거하여 CON구와 FP구에는 매일 체중의 15%에 해당하는 사료를 오전, 오후로 나누어 공급하였다. 한편 FL구의 경우 FP구의 개나리 잎 분말 무게에 해당하는 냉동 개나리 잎을 공급하였으며, 이 개나리 잎의 무게를 포함하여 체중의 15%에 해당하는 배합사료를 오전, 오후로 나누어 공급하였다. 사료 공급 시마다 수온과 탈피여부를 체크하였고, 매일 50%의 사육수를 환수하였다. 실험 기간 중 사육수온은 수중 히터를 이용하여 28 ± 1℃로 유지하였다.
3. 생존율 및 성장률
생존율 조사를 위해 실험 시작 시점부터 종료 시점까지 매일 2회씩 관찰해 폐사 발생여부 및 폐사일을 기록하였다. 그리고 실험 시작 시점, 5주 경과 시점, 10주 경과 시점(실험 종료 시점)에 각각 모든 실험구의 개체를 포획해 체중을 측정하여 성장률을 비교하였다.
4. 체색 변화
체색 관찰을 위해 2주에 1회씩 모든 개체를 한 마리씩 실측용 아크릴수조에 넣어 측정한 후 촬영하였다. 매 측정 시마다 한 개체당 측면 사진, 상면 사진의 2종류의 사진을 촬영하였다. 촬영 시에는 동일한 조건을 마련하기 위해 암실 내에서 일정한 광원(오스람 LED 전구, 6,500 K, 11 W)을 준비해 같은 위치와 각도로 촬영수조에 비추었다. 카메라의 촬영조건은 6,500 K의 화이트밸런스, 50의 ISO로 통일하였으며 셔터스피드는 측면 사진의 경우 1/180, 상면 사진의 경우 1/750로 정하였다. 촬영은 개체가 받는 스트레스를 최소화하기 위해 사육수조와 동일한 수온의 물을 사용해 신속하게 진행하였다. 이렇게 확보한 이미지는 체색 분석을 위한 RGB 값 측정에 사용하였다. 이후 Adobe Photoshop의 Eye- dropper Tool을 사용해 새우의 체색을 정량화하였다(Fig. 2). 체색을 측정한 영역은 제2복부체절의 중앙으로 정하였는데, 이는 해당 영역이 새우 전체 체색을 대변할 수 있는 부위로 활용되기 때문이다(Calvo et al., 2016).

실험 종료 시에는, 각 수조에서 무작위로 1마리씩 총 9마리의 새우를 골라 가열 후 체색 비교에 사용하였다. 끓는 물(100℃)에서 3분간 중탕 가열한 뒤, 동일한 광원과 촬영조건을 설정하여 촬영 후 체색을 분석하였다.
5. 간췌장 조사
실험 종료 시 각 수조당 무작위로 1마리의 새우를 선택하여(실험구 당 3마리) 간췌장의 조직학적 변화를 조사하였다. 간췌장의 손상을 최소화하기 위해 얼음 위에서 새우를 해부해 간췌장을 채취하고, 바로 10% 중성포르말린 용액에 고정하였다. 이어서 조직의 높이가 5 mm 가량 되도록 절단한 다음, 파라핀상법을 이용하여 간췌장 세관의 횡단면을 관찰할 수 있는 방향으로 포매하였다. 포매한 블록은 박절의 완성도를 높이기 위해 60% 에탄올과 글리세린의 1:9 혼합액에 24시간 가량 담궈 연화시켰다. 이후 회전식 박절기를 사용해 약 5 μm 두께의 절편을 얻어내 hematoxylin-eosin으로 염색하여 광학현미경으로 관찰하였다.
6. 통계 처리
실험 결과는 평균값과 표준오차(mean ± SEM)으로 나타내었다(n=3). One-way ANOVA를 이용하여 생존율, 성장률, 체색 인자와 간췌장 액포의 크기차이를 비교하였고 Duncan test로 실험구 평균간 유의차를 분석하였다(SPSS Statistics 20, p<0.05).
결 과
1. 생존율 및 성장률
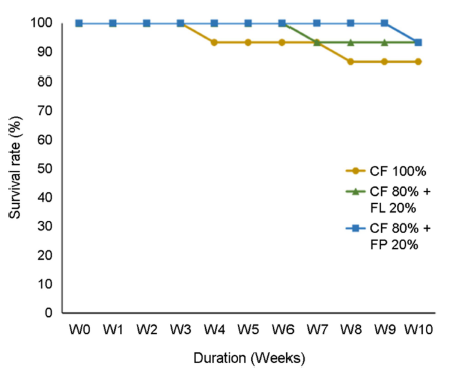
개나리 잎을 공급한 큰징거미새우(M. rosenbergii)의 생존율 및 성장률을 Fig. 3, 4에 나타내었다. 생존율과 성장률 모두 대조구, FP구, FL구 사이에 유의한 차이가 관찰되지 않았다(Fig. 3, 4, p>0.05). 생존율의 경우를 살펴보면, CON의 경우 4주차에 한 마리, 8주차에 한 마리로 총 두 마리의 폐사가 발생하였으며, FL구의 경우 6주차에 한 마리의 폐사가 발생하였고 FP구의 경우 9주차에 한 마리의 폐사가 발생하였다. 실험 종료 시점에서 FL구와 FP구는 각각 93.3 ± 6.6%, 대조구는 86.6 ± 6.6%의 생존률을 보여주었다.
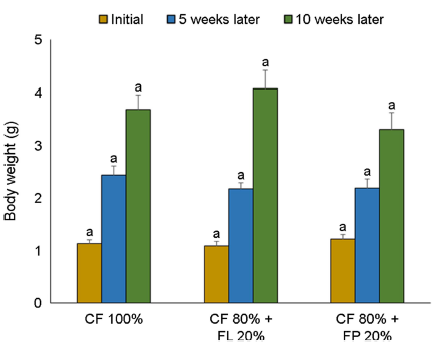
한편 성장률의 경우를 살펴보면, 사육을 시작하고 5주차에 접어든 시점에서의 개체당 무게의 경우 대조구는 2.42 ± 0.18 g, FP구는 2.18 ± 0.17 g, FL구는 2.16 ± 0.43 g을 나타내었다. 10주차에 접어들어 실험 종료 시점에는, 대조구는 3.68 ± 0.28 g, FP구는 3.29 ± 0.33 g, FL구는 4.07 ± 0.34 g을 나타내었다(Fig. 4, p<0.05).
2. 체색 변화
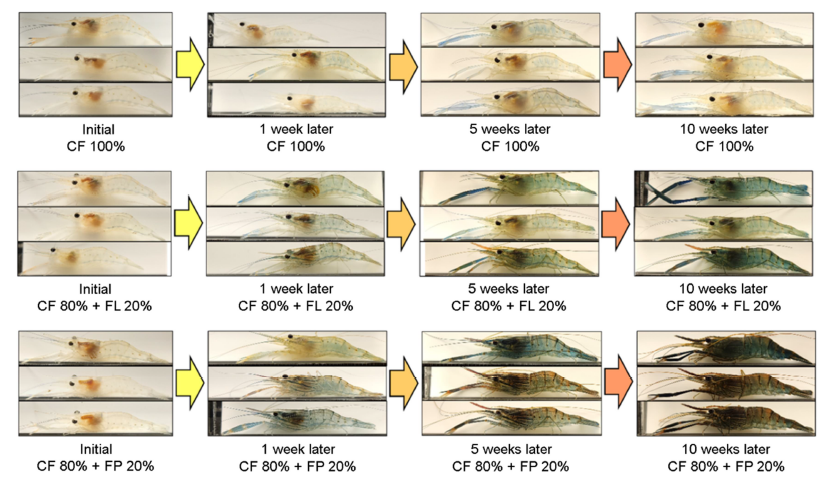
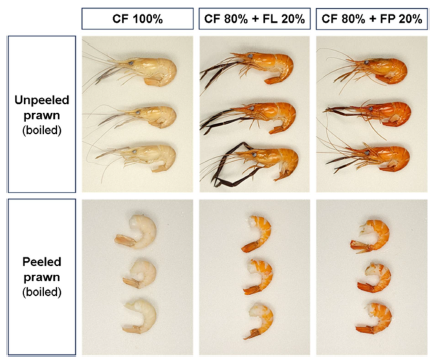
7주간의 사육실험 후, 실험 새우들의 체색 변화를 Fig. 5에 나타내었다. 대조구의 개체들은 사육일이 경과해도 체색의 변화가 거의 없이 일관적으로 옅은 유백색을 유지한 반면, FP와 FL구의 새우는 모두 사육일의 경과에 따라 옅은 청색을 거쳐 체색이 점점 짙어졌으며 최종적으로 흑갈색 혹은 암청색으로 변하였다. 한편 끓는 물에서 3분간 가열한 후 실험 새우의 체색 변화를 Fig. 6에 나타내었다. 갑각을 벗기지 않은 상태의 체색의 경우, 대조구는 가열 후에도 가열 전과 큰 변화가 없는 유백색을 유지하였으나, FP와 FL구는 가열 후 선명한 적색을 띠게 되었다. 그리고 이러한 경향은 갑각을 벗겨낸 상태의 꼬리근육에도 똑같이 적용되어, 대조구의 꼬리근육은 전체적으로 유백색을 띠는 반면 FP와 FL구의 꼬리근육은 체절의 특정 영역마다 선명한 적색을 띠었다.
체색의 R, G, B, 값과 Lightness(밝기)를 분석한 결과를 살펴보면, 첫 번째로, R 값의 경우, 시작 시에는 모든 그룹이 평균적으로 209.8 ± 1.1의 값을 나타내었으나, 실험 종료 시점에서는 대조군의 경우 191.0 ± 3.1, 개나리 생잎 공급군의 경우 126.6 ± 7.6, 개나리 잎 분말 첨가 사료 공급군의 경우 89.3 ± 5.5의 값이 계산되어 유의한 차이를 확인하였다(Fig. 7, p<0.05).
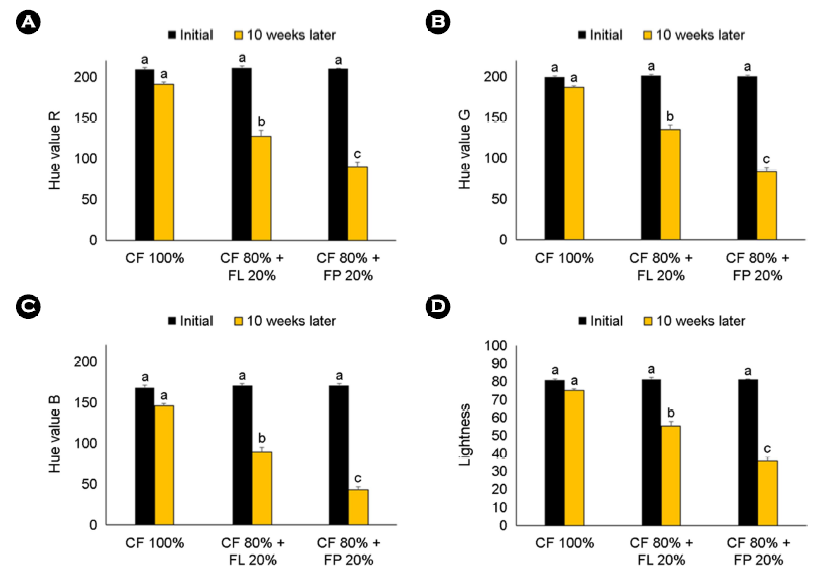
G 값의 경우, 시작 시에는 모든 그룹이 평균적으로 200.7 ± 0.6의 값을 나타내었으나, 실험 종료 시점에서는 대조군의 경우 186.7 ± 2.6, 개나리 생잎 공급군의 경우 134.8 ± 5.8, 개나리 잎 분말 첨가 사료 공급군의 경우 84.1 ± 4.9의 값이 계산되어 유의한 차이를 확인하였다(Fig. 7, p<0.05).
B 값의 경우, 시작 시에는 모든 그룹이 평균적으로 169.8 ± 0.9의 값을 나타내었으나, 실험 종료 시점에서는 대조군의 경우 145.5 ± 3.2, 개나리 생잎 공급군의 경우 89.1 ± 5.4, 개나리 잎 분말 첨가 사료 공급군의 경우 43.3 ± 3.3의 값이 계산되어 유의한 차이를 나타내었다(Fig. 7, p<0.05).
밝기의 경우, 시작 시에는 모든 그룹이 평균적으로 81.0 ± 0.2의 값을 나타내었으나, 실험 종료 시점에서는 대조구의 경우 75.0 ± 0.9, FL구의 경우 55.4 ± 2.3, FP구의 경우 35.7 ± 2.1의 값이 계산되어 유의한 차이를 나타내었다(Fig. 7, p<0.05).
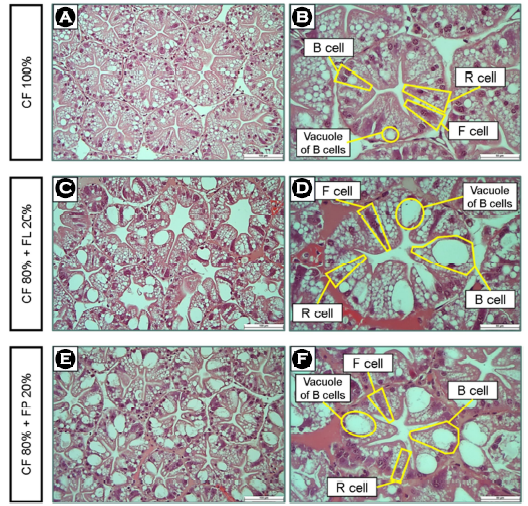
3. 간췌장의 조직학적 구조
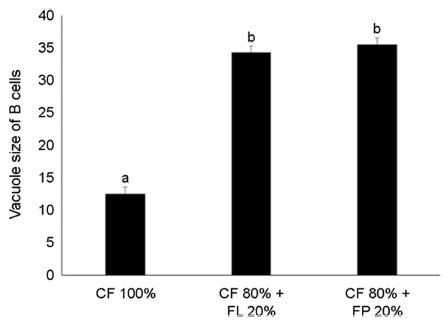
개나리 잎을 공급한 큰징거미새우(M. rosenbergii)의 간췌장 구조에 대한 결과는 Fig. 8에 표시되어 있다. 세 실험구 모두 정상적인 모양과 세포의 비율을 가지고 있었다. 그러나 FP와 FL구 새우의 B세포의 액포 크기는 대조구에 비하여 유의하게 컸는데, 대조구는 평균 12.5 ± 0.2 μm, 개나리 생잎 공급군은 34.2 ± 0.4 μm, 개나리 잎 분말 공급군은 35.5 ± 0.9 μm를 나타내었다(Fig. 9, p<0.05).
고 찰
1. 개나리 잎 공급에 의한 성장률의 변화
수산양식에 사용되는 총 비용 중 가장 높은 비중을 차지하는 요인은 사료비이다(Baki and Yücel, 2017). 사료비에 소요되는 비용은 일반적으로 총 비용의 40~75%에 이르며, 성공적인 수산양식을 위한 핵심 관리 요인 중 하나이다(Ansari et al., 2021). 따라서 양식에 소요되는 배합사료를 절약하거나, 배합사료의 재료인 어분의 대체원료를 발굴하려는 시도는 의미있는 일이다. 그 중 본 연구와 유사한 Macrobrachium 속 새우의 양식에 식물성 사료원이 적용된 예를 살펴보면, Man et al. (2017)은 큰징거미새우 juvenile을 위한 배합사료의 제작에서 은자귀나무(Leucaena leuco- cephala Lam.) 분말을 어분 대체재로 첨가할 경우, 성장 속도의 저해 없이 최대 25%의 어분을 대체할 수 있다고 보고했다. Huang et al. (2018)도, 징거미새우(M. nipponense)의 사료에서 대두박과 면실박을 이용하여 각각 최대 25%의 어분을 대체할 수 있음을 확인했다. 또한 Radhakrishnan et al. (2016)에 의하면, 큰징거미새우의 후기유생 육성용 사료 제작 시 미세조류인 스피루리나(Arthrospira platensis)로 어분의 50%를 대체할 경우, 어분이 기존 비율대로 첨가된 일반 배합사료를 공급한 그룹보다 우수한 성장능력을 보였다. 심지어 어분을 스피루리나로 100% 대체하더라도 일반 배합사료를 공급한 그룹과 성장성능에서 차이를 보이지 않았다. 본 연구에서는 FP와 FL구의 성장률은 대조구의 성장률과 유의한 차이가 없었다. 이는 큰징거미새우 치하의 육성에 있어 개나리 잎이 배합사료의 20% 가량을 대체하여도 문제가 없음을 시사한다.
2. 개나리 잎 공급에 의한 체색의 개선
체색은 갑각류의 시장가치를 결정하는 직접적이고 중요한 요인이다(Lorenz, 1998). 선명하고 짙은 체색은 신선하고 유기농 양식된 갑각류라는 증거로 여겨지며, 수요와 가격에 긍정적인 영향을 미친다(Alam et al., 2022). 본 연구에서, 큰징거미새우의 10주에 걸친 체색 변화를 살펴보면, 2가지 방식의 개나리 잎 공급군의 경우 처음에는 흰색이었던 체색이 개나리 잎의 섭취에 의해 청색으로 변하여 점점 짙어지는 것을 관찰할 수 있다. 갑각류의 체색을 이루는 주된 색소는 붉은색 카로티노이드계 색소인 아스타잔틴이다. 갑각류의 체색은 피하 발색단과 표피 외골격의 색소층에 있는 카로티노이드계 색소의 질적, 양적 존재에 따라 달라진다(Lorenz, 1998). 그러나 지구의 생물들 중 식물과 원생생물(박테리아, 조류, 곰팡이) 종류만이 카로티노이드를 합성할 수 있으며, 갑각류는 카로티노이드를 생합성 할 수 없다(Lorenz, 1998). 따라서 갑각류는 체색의 재료를 먹이원에 포함된 색소에 의존한다(Goodwin, 1952). 갑각류들은 다양한 종류의 카로티노이드계 색소를 섭취한 뒤 붉은색인 아스타잔틴으로 전환시키며, 그 경로는 (Negresadargues, 1978; Castillo et al., 1982; Schiedt et al., 1993)에 의해 서술되어 있다. 체내에서의 아스타잔틴 합성 이후, 갑각류들은 붉은 색소인 아스타잔틴을 apo crustacyanin 단백질과 결합시켜 색소단백질 복합체(carotenoprotein)를 형성한다(Wade et al., 2009). 이 때 아스타잔틴과 단백질 사이의 특정 분자 상호작용으로 인해 스펙트럼의 장파장 이동(bathochromic shift)이 발생하고, 가시 스펙트럼이 바뀌어 갑각류 종마다의 고유 체색을 띨 수 있게 된다(Cianci et al., 2002; Bhosale and Bernstein, 2007). 따라서 본 실험에서 관찰된 체색의 개선은 개나리 잎에 함유된 베타카로틴과 같은 카로티노이드계 색소의 섭취 및 체내에서의 아스타잔틴으로의 전환에 의한 결과로 추측된다.
체색의 극적인 변화는 끓는 물에 3분간 가열한 후에도 나타났다. 대조구의 갑각 및 꼬리근육의 색은 가열 전후가 크게 다르지 않은 유백색이었으나, 개나리 공급구의 갑각과 꼬리근육 모두 선명한 적색으로 변했다. 조리된 갑각류 특유의 적색은, 외골격과 근육에 축적되어 있던 색소단백질 복합체가 고온에 의해 변성되며 아스타잔틴이 다시 방출되어 나와 색소 본래의 색을 띠게 되는 것이 그 이유이다(Gao et al., 2021). 갑각류는 체색의 재료인 카로티노이드계 색소를 먹이를 통해서만 얻을 수 있고(Goodwin, 1952), 가열 시 체색의 깊이는 카로티노이드의 함량에 따라 결정된다(Okada et al., 1994). 따라서 대조구가 가열 전후 변화 없이 유백색이었던 이유는 카로티노이드계 색소를 거의 섭취하지 못하여 외골격 및 근육에 아스타잔틴이 부족했기 때문임을 추측 가능하다. 반대로 개나리 공급구를 가열했을 때 선명한 적색을 띠게 된 이유는 외골격 및 근육에 아스타잔틴을 충분히 함유하고 있었기 때문일 것이며, 먹이를 통해 충분한 양의 카로티노이드계 색소를 섭취하는 것이 가능했다는 방증이다. 카로티노이드는 체색, 건강, 성장과 같은 다양한 파라미터에 걸쳐 갑각류 양식에 유익한 효과가 일관적으로 보고되어 있고, 현재 갑각류 양식을 위한 고성능 배합사료에는 다양한 천연 및 합성 카로티노이드 공급원이 보충되는 경우가 많다(Wade et al., 2017). 지금껏 갑각류 양식에 활용되는 카로티노이드계 색소의 공급원에는 미세조류(Supamattaya et al., 2005), 남조류(Nur-E-Borhan, 1993), 다양한 식물 추출물(Figueroa et al., 2003; Vernon-Carter et al., 2006) 등이 있다. 본 연구의 결과는 개나리 생잎 또는 개나리 잎 건조분말이 큰징거미새우의 양식을 위한 천연 카로티노이드계 색소원으로 먹이에 활용될 수 있음을 보여준다.
3. 개나리 잎 공급에 의한 간췌장 구조의 변화
간췌장의 조직형태를 살펴보면, 간췌장의 형태적 기능 단위라고 할 수 있는 간췌장 세관(hepatopancreatic tubule)들이 수백 개 모여 이루어진 형태임을 확인할 수 있다. 또한, 간췌장 세관은 E (embryonic, 배아), F(fibrillar, 원섬유), R(reabsorption, 재흡수), B (blister, 수포), M(midget, 난쟁이) 의 5가지 유형의 세포로 구성된 상피로 둘러싸여 있다(Ruiz et al., 2020). 이 세포들은 간췌장에서 다양한 기능을 수행하는데, 유사분열과 상피세포 재생(E 세포), 소화효소 생성 및 세포외 소화(F 세포), 지질 및 글리코겐 저장(R 세포), 세포 내 소화 및 영양분 동화(B 세포), 영양분 저장 및 내분비 조절(M 세포) 등이 밝혀져 있다(Silva et al., 2018; Ruiz et al., 2020). 이러한 간췌장의 조직학적 분석은 갑각류의 영양상태 및 건강을 평가하기 위한 실용적인 지표로 활용된다(Cervellione et al., 2017; Pourmozaffar et al., 2019b). 본 연구에서 간췌장을 횡단면으로 절단해 조직표본을 제작하여 관찰한 결과, FP와 FL구의 새우는 대조구에 비해 B 세포의 액포 크기가 유의하게 크다. B 세포는 간췌장 세관 상피를 구성하는 세포 중 가장 큰 종류인데, 둥근 핵을 갖는 구형이며 호산성의 세포질을 특징으로 한다. 갑각류의 건강과 B 세포의 관계에 주목한 연구들을 살펴보면, Méndez-Martínez et al. (2018)의 경우, Cauque river prawn (M. americanum)의 최적 양식사료 개발을 목적으로 단백질/지질 비율을 테스트한 결과, 가장 우수한 증체량, 성장률, 간중량지수를 얻어낸 단백질/지질 비율의 사료 공급구에서 확연한 B 세포의 크기 증가를 보고했다. 이러한 현상은 징거미새우(M. nipponense)를 대상으로 한 연구에서도 유사하게 관찰되었는데, 사료 효율과 증체량이 향상될수록 B 세포의 액포 크기가 증가하였다(Zhang et al., 2017). Xiao et al. (2014)는 미국가재(Procambarus clarkii)의 사료에 단백질원의 대체재로 옥수수 전분을 활용하기 위한 연구를 수행하였는데, 사료에 옥수수 전분의 함유량이 증가함에 따라 B 세포의 액포 크기가 증가함을 관찰했다. 이는 α-아밀라아제의 경향성과 일치하였고, 따라서 B 세포의 이러한 변화는 소화효소의 합성과 배설을 촉진해 가재가 전분의 소화를 강화하고 섭취한 먹이에서 더 많은 에너지를 얻기 위한 현상으로 해석했다. 지금까지 밝혀진 B 세포의 주 기능이 영양소의 흡수와 소화인 것을 고려하면, 본 연구에서 관찰된 개나리 잎 공급구의 B 세포 크기 증가의 이유는 왕성한 소화활동의 증거 및 음세포작용에 의해 충분히 영양소를 흡수한 결과라는 긍정적인 신호로 이해된다. 한편, B 세포 액포의 크기 증가는 부정적인 의미로 해석되기도 하였다. 보리새우에게 저온 스트레스를 가한 결과 B 세포의 액포 확장이 관찰되었으며(Ren et al., 2020), bristled river shrimp (M. olfersii)를 대상으로 UVB를 조사하게 되면 B세포 액포의 부피 증가가 보고되기도 하였다(Müller et al., 2020). 본 연구에서는 B 세포 액포의 크기 증가가 성장 저해 및 외견상 스트레스의 징후와 연관되지는 않았다. 그러나 이는 약 3개월간의 단기 사육실험에 대한 결과이므로 간췌장의 구조와 생물의 건강에 관한 추가 연구가 요구된다.
4. 결론
본 연구의 결과는 큰징거미새우에게 개나리 잎을 공급할 경우 간췌장 건강과 체색을 개선할 수 있으며 배합사료의 20% 가량을 대체해도 성장 및 생존률에 부정적 영항을 미치지 않는다는 것을 보여주었다. 특히 체색에 대해 극적인 개선 효과를 나타내었는데, 이는 본 연구에서 제작한 개나리 잎 분말 혹은 생 개나리 잎의 투입이 충분한 양의 카로티노이드계 색소의 공급원이 될 수 있음을 의미한다. 앞으로의 연구에서는 보다 많은 큰징거미새우를 대상으로 양식장 규모의 검증실험을 실시할 필요가 있다.
- References
-
1. Alam MI, Yeasmin S, Khatun MM, Rahman MM, Ahmed MU, Debrot AO, Ahmed MU, Verdegem M. 2022. Effect of man- grove leaf litter on shrimp (Penaeus monodon, Fabricius, 1798) growth and color. Aquaculture Reports 25: 101185.
-
2. Amaya E, Nickell D. 2015. Using feed to enhance the color quality of fish and crustaceans. Feed and feeding practices in aqua- culture: 269-298.
-
3. Ansari FA, Guldhe A, Gupta SK, Rawat I, Bux F. 2021. Improving the feasibility of aquaculture feed by using microalgae. Environmental Science and Pollution Research 28: 43234-43257.
-
4. Baki B, Yücel Ş. 2017. Feed cost/production income analysis of seabass (Dicentrarchus labrax) aquaculture. International Journal of Ecosystems & Ecology Sciences 7.
-
5. Bhosale P, Bernstein PS. 2007. Vertebrate and invertebrate carotenoid-binding proteins. Archives of Biochemistry and Biophysics 458: 121-127.
-
6. Boonyaratpalin M, Thongrod S, Supamattaya K, Britton G, Schlipalius L. 2001. Effects of β-carotene source, Dunaliella salina, and astaxanthin on pigmentation, growth, survival and health of Penaeus monodon. Aquaculture Research 32: 182-190.
-
7. Brotosudarmo THP, Limantara L, Setiyono E. 2020. Structures of astaxanthin and their consequences for therapeutic appli- cation. International Journal of Food Science 2020.
-
8. Calvo NS, RoldÁn-Luna M, Argáez-Sosa JA, Martínez-Moreno GL, Mascaró M, Simões N. 2016. Reflected-light influences the coloration of the peppermint shrimp, Lysmata boggessi (Decapoda: Caridea). Journal of the World Aquaculture Society 47: 701-711.
-
9. Castillo R, Nègre-Sadargues G, Lenel R. 1982. General survey of the carotenoids in Crustacea. In Carotenoid chemistry and biochemistry (pp 211-224): Elsevier.
-
10. Cervellione F, McGurk C, Silva P, Owen M, Van Den Broeck W. 2017. Optimization of fixation methods for image analysis of the hepatopancreas in whiteleg shrimp, Penaeus vannamei (Boone). Journal of Fish Diseases 40: 517-527.
-
11. Cianci M, Rizkallah PJ, Olczak A, Raftery J, Chayen NE, Zagalsky PF, Helliwell JR. 2002. The molecular basis of the coloration mechanism in lobster shell: β-crustacyanin at 3.2-Å resolution. Proceedings of the National Academy of Sciences 99: 9795-9800.
-
12. FAO. 2023. FAO Fisheries and Aquaculture Division. FAO, Fishery and Aquaculture Statistics – Yearbook 2020. FAO., Rome, Italy, p 113.
-
13. Fernández Gimenez AV, Fenucci JL, Petriella AM. 2004. The effect of vitamin E on growth, survival and hepatopancreas struc- ture of the Argentine red shrimp Pleoticus muelleri Bate (Crustacea, Penaeidea). Aquaculture Research 35: 1172-1178.
-
14. Figueroa JA, Islas RP, Palafox JP, Carter EV. 2003. Pigmentation of pacific white shrimp (Litopenaeus vannamei, Boone 1931) with esterified and saponified carotenoids from red chili (Capsicum annuum) in comparison to astaxanthin. Revista Mexicana de Ingeniería Química 2: 101-108.
-
15. Gao H, Ma H, Sun J, Xu W, Gao W, Lai X, Yan B. 2021. Expression and function analysis of crustacyanin gene family involved in resistance to heavy metal stress and body color formation in Exopalaemon carinicauda. Journal of Experimental Zoology Part B: Molecular and Developmental Evolution 336: 352-363.
-
16. Goodwin TW. 1952. The comparative biochemistry of the carote- noids. The comparative biochemistry of the carotenoids. Chapman & Hall. London. pp 1-356.
-
17. Habashy M, Raafat HA. 2008. The juvenile freshwater prawn, Macrobrachium rosenbergii (Crustacea-Decapoda) as an effective zooplankton predator. Egyptian Journal of Aquatic Biology and Fisheries 12: 75-84.
-
18. Han SH, Kim DH, Kim GN, Byeon JG. 2011. Changes of Leaf Char- acteristics, Pigment Content and Photosynthesis of Forsythia saxatilis under Two Different Light Intensities. Journal of Korean Forest Society 100: 609-615.
-
19. Harpaz S, Rise M, Arad S, Gur N. 1998. The effect of three carote- noid sources on growth and pigmentation of juvenile freshwater crayfish Cherax quadricarinatus. Aquaculture Nutrition 4: 201-208.
-
20. Harpaz S, Schmalbach EA. 1986. Improved growth and health of the Malaysian prawn, Macrobrachium rosenbergii, by addition of fresh leaves to the artificial diet. Aquaculture 55: 81-85.
-
21. Hooper C, Debnath PP, Stentiford GD, Bateman KS, Salin KR, Bass D. 2023. Diseases of the giant river prawn Macrobrachium rosenbergii: A review for a growing industry. Reviews in Aquaculture 15: 738-758.
-
22. Huang Y-J, Zhang N-N, Fan W-J, Cui Y-Y, Limbu SM, Qiao F, Zhao Y-L, Chen L-Q, DU Z-Y, Li D-L. 2018. Soybean and cottonseed meals are good candidates for fishmeal replacement in the diet of juvenile Macrobrachium nipponense. Aquaculture International 26: 309-324.
-
23. Kaldre K, Haugjärv K, Liiva M, Gross R. 2015. The effect of two different feeds on growth, carapace colour, maturation and mortality in marbled crayfish (Procambarus fallax f. virginalis). Aquaculture International 23: 185-194.
-
24. Kildegaard KR, Adiego-Pérez B, Belda DD, Khangura JK, Holkenbrink C, Borodina I. 2017. Engineering of Yarrowia lipolytica for production of astaxanthin. Synthetic and Systems Biotechnology 2: 287-294.
-
25. Kumar AR, Rao GV, Rao KS. 2004. Appendage deformity syndrome a nutritional disease of Macrobrachium rosenbergii. Diseases of Aquatic Oganisms 59: 75-78.
-
26. Lee EJ, Yoo KS, Patil BS. 2011. Total carotenoid, anthocyanin, and sugar contents in sliced or whole purple (cv. Betasweet) and orange carrots during 4-week cold storage. Horticulture, Environment, and Biotechnology 52: 402-407.
-
27. Li J, Zhu D, Niu J, Shen S, Wang G. 2011. An economic assess- ment of astaxanthin production by large scale cultivation of Haematococcus pluvialis. Biotechnology Advances 29: 568-574.
-
28. Lim KC, Yusoff FM, Shariff M, Kamarudin MS. 2018. Astaxanthin as feed supplement in aquatic animals. Reviews in Aquaculture 10: 738-773.
-
29. Liu M, Jiang X, Chen A, Chen T, Cheng Y, Wu X. 2020. Tran- scriptome analysis reveals the potential mechanism of dietary carotenoids improving antioxidative capability and immunity of juvenile Chinese mitten crabs Eriocheir sinensis. Fish & Shellfish Immunology 104: 359-373.
-
30. Long X, Wu X, Zhao L, Liu J, Cheng Y. 2017. Effects of dietary supplementation with Haematococcus pluvialis cell powder on coloration, ovarian development and antioxidation capacity of adult female Chinese mitten crab, Eriocheir sinensis. Aquaculture 473: 545-553.
-
31. Lorenz T. 1998. A review of the carotenoid, astaxanthin, as a pigment and vitamin source for cultured Penaeus prawn. Naturose Tech Bull 1: 1-7.
-
32. Müller YMR, de Melo MS, Weiss VMC, de Quadros T, Ammar D, Nazari EM. 2020. Ultraviolet B radiation affects epithelial cell morphology and ultrastructure in the hepatopancreas of the freshwater decapod Macrobrachium olfersii. Ecotoxicology and Environmental Safety 204: 111096.
-
33. Méndez-Martínez Y, García-Guerrero MU, Arcos-Ortega FG, Martínez-Córdova LR, Yamasaki-Granados S, Pérez-Rodríguez JC, Cortés-Jacinto E. 2018. Effect of different ratios of dietary protein-energy on growth, body proximal composition, di- gestive enzyme activity, and hepatopancreas histology in Macrobrachium americanum (Bate, 1868) prawn juveniles. Aquaculture 485: 1-11.
-
34. Man MD, Mamat N, Affendi I, Nih S, Nadzri A. 2017. Partial replacement of fish meal by white leadtree meal in diets for juveniles of Giant River Prawn, Macrobrachium rosenbergii (De Man, 1879). International Journal of Fisheries and Aquatic Studies 5: 154-157.
-
35. Muralisankar T, Bhavan PS, Radhakrishnan S, Santhanam P. 2018. Dietary Supplement of Medicinal Herbal Leaf Powder on Growth Performance, Digestive Enzymes Activities, Energy Utilization and Vitamin Levels of the Freshwater Prawn Macrobrachium rosenbergii. Proceedings of the Zoological Society 71: 265-271.
-
36. Negresadargues G. 1978. Metabolic transformations of carotenoid pigments in crustacea literature survey. Annee Biologique 17: 415-454.
-
37. New M. 2002. A manual for the culture of the giant river prawn (Macrobrachium rosenbergii). FAO Fisheries Technical Paper 428.
-
38. Nur-E-Borhan SA. 1993. Pigmentation of Cultured Black Tiger Prawn by Feeding with a Spirulina-Supplemented Diet. Nippon Suisan Gakkaishi 59: 165-169.
-
39. Okada S, Nur-E-Borhan SA, Yamaguchi K. 1994. Carotenoid com- position in the exoskeleton of commercial black tiger prawns. Fisheries Science 60: 213-215.
-
40. Panis G, Carreon JR. 2016. Commercial astaxanthin production derived by green alga Haematococcus pluvialis: A micro- algae process model and a techno-economic assessment all through production line. Algal Research 18: 175-190.
-
41. Pourmozaffar S, Hajimoradloo A, Paknejad H, Rameshi H. 2019a. Effect of dietary supplementation with apple cider vinegar and propionic acid on hemolymph chemistry, intestinal micro- biota and histological structure of hepatopancreas in white shrimp, Litopenaeus vannamei. Fish & Shellfish Immunology 86: 900-905.
-
42. Pourmozaffar S, Tamadoni Jahromi S, Rameshi H, Gozari M. 2019b. Evaluation of some haemolymph biochemical properties and F-cell prevalence in hepatopancreas of white leg shrimp (Litopenaeus vanammei) after fed diets containing apple cider vinegar and propionic acid. Aquaculture Research 50: 3435-3443.
-
43. Prathomya P, Hussein HA, Tran NT, Duan YH, Peng SH, Xu Y, Qian WQ, Wang GT. 2019. Effects of dietary supplemen- tation of Astragalus membranaceus, Codonopsis pilosula, and Glycyrrhiza uralensis extract mixture on growth performance, haematological parameters and hepatopancreatic perform- ance in juvenile Pacific white shrimp (Litopenaeus vannamei). Aquaculture Research 50: 2707-2717.
-
44. Radhakrishnan S, Belal IE, Seenivasan C, Muralisankar T, Bhavan PS. 2016. Impact of fishmeal replacement with Arthrospira platensis on growth performance, body composition and digestive enzyme activities of the freshwater prawn, Macro- brachium rosenbergii. Aquaculture Reports 3: 35-44.
-
45. Ranjeet K, Kurup B. 2002. Heterogeneous individual growth of Macrobrachium rosenbergii male morphotypes. Naga, The ICLARM Quarterty 25: 13-18.
-
46. Reddy HRV, Naik MG, Annappaswamy TS. 1999. Evaluation of the dietary essentiality of vitamins for Penaeus monodon. Aquaculture Nutrition 5: 267-275.
-
47. Ren X, Yu Z, Xu Y, Zhang Y, Mu C, Liu P, Li J. 2020. Integrated transcriptomic and metabolomic responses in the hepato- pancreas of kuruma shrimp (Marsupenaeus japonicus) under cold stress. Ecotoxicology and Environmental Safety 206: 111360.
-
48. Rodríguez CEB, García AC, Ponce-Palafox JT, Spanopoulos-Hernández M, Puga-López D, Arredondo-Figueroa JL, Cárdenas LM. 2017. The color of marine shrimps and its role in the aquaculture. International Journal of Aquaculture and Fishery Sciences 3: 062-065.
-
49. Ruiz TFR, Vidal MR, Ribeiro K, Vicentini CA, Vicentini IBF. 2020. Histology of the hepatopancreas and anterior intestine in the freshwater prawn Macrobrachium carcinus (Crustacea, Decapoda). Nauplius 28.
-
50. Schiedt K, Bischof S, Glinz E. 1993. Metabolism of carotenoids and in Vivo racemization of (3S, 3' S)-Astaxanthin in the crustacean Penaeus. In Methods in enzymology (Vol. 214, pp 148-168): Elsevier.
-
51. Setyastuti T, Sukamto D, Fawwaz I. 2022. Analysis of causes of changes in conditions of vannamei shrimp hepatopancreas indicators at PT. Lombang Sumber Rejeki Sumenep. Paper presented at the IOP Conference Series: Earth and Environ- mental Science.
-
52. Silva M, Almeida Neto M, Ramiro B, Santos I, Guerra R. 2018. Histomorphologic characterization of the hepatopancreas of freshwater prawn Macrobrachium rosenbergii (De Man, 1879). Arquivo Brasileiro de Medicina Veterinária e Zootecnia 70: 1539-1546.
-
-
54. Supamattaya K, Kiriratnikom S, Boonyaratpalin M, Borowitzka L. 2005. Effect of a Dunaliella extract on growth performance, health condition, immune response and disease resistance in black tiger shrimp (Penaeus monodon). Aquaculture 248: 207-216.
-
55. Vernon-Carter E, Ponce-Palafox J, Arredondo-Figueroa J. 2006. Carotenoids from plants used in diets for the culture of the pacific white shrimp (Litopenaeus vannamei). Revista Mexicana de Ingeniería Química 5: 157-165.
-
56. Vogt G. 2019. Functional cytology of the hepatopancreas of decapod crustaceans. Journal of Morphology 280: 1405-1444.
-
57. Wade NM, Budd A, Irvin S, Glencross BD. 2015. The combined effects of diet, environment and genetics on pigmentation in the giant tiger prawn, Penaeus monodon. Aquaculture 449: 78-86.
-
58. Wade NM, Gabaudan J, Glencross BD. 2017. A review of carote- noid utilisation and function in crustacean aquaculture. Reviews in Aquaculture 9: 141-156.
-
59. Wade NM, Tollenaere A, Hall MR, Degnan BM. 2009. Evolution of a novel carotenoid-binding protein responsible for crustacean shell color. Molecular Biology and Evolution 26: 1851-1864.
-
60. Wang JY, Shen JS, Gu M, Wang J, Cheng TR Pan HT, Zhang QX. 2017. Leaf coloration and photosynthetic characteristics of hybrids between Forsythia 'Courtaneur' and Forsythia koreana 'Suwon Gold'. HortScience 52: 1661-1667.
-
61. Wang W, Ishikawa M, Koshio S, Yokoyama S, Hossain MS, Moss AS. 2018a. Effects of dietary astaxanthin supplementation on juvenile kuruma shrimp, Marsupenaeus japonicus. Aqua- culture 491: 197-204.
-
62. Wang Y, Zhou Q, Shi N, Huo C, Jin S. 2018b. A new bisepoxylignan glucoside from the leaves of Forsythia suspensa. Chemistry of Natural Compounds 54: 1038-1040.