JMLS 2023 December;8(2):160-165. 10.23005/ksmls.2023.8.2.160 Epub 2023 December 17
Copyright © 2023 by The Korean Society of Marine Life Science
Microscopical Anatomy of Integumentary System of the Walleye Pollock Gadus chalcogrammus (Teleostei: Gadidae)
Hyeon Jin Kim; Department of Aqualife Medicine, Chonnam National University, Yeosu 59626, Korea
So Ryung Shin; Department of Aqualife Medicine, Chonnam National University, Yeosu 59626, Korea
Jae Won Kim; Department of Aquaculture, Gangwon State University, Gangneung 25425, Korea
Jung Sick Lee; Department of Aqualife Medicine, Chonnam National University, Yeosu 59626, Korea
- Abstract
본 연구는 생리적, 환경적 변화에 따른 명태 Gadus chalcogrammus 피부계의 변화 연구를 위한 기초 연구로서 피부계의 구조, 구성 세포 종류 및 조직화학적 특징을 기재하였다. 측선은 전반부가 완만한 곡선형이었으며, 중반부터 후반부까지는 직선으로 나타났다. 피부는 상피층과 진피층으로 구성되며, 상피층은 다층으로 상피세포, 점액세포, 곤봉세포로 이루어져 있다. 상피세포는 표면층의 편평형 세포, 중간층의 입방형 세포, 기저층의 원주형 세포로 구성된다. 상피층의 두께는 122.9 μm, 체장에 대한 상피층의 두께 비율은 0.03%였다. 단세포선인 점액세포와 곤봉세포는 주로 상피층의 표면층과 중간층에 분포하며, 점액세포는 산성 당단백질의 점액물질을 함유하고 있었다. 상피층에서 점액세포와 곤봉세포의 분포비율은 각각 21.3 (± 7.0.)%와 4.0 (± 1.0)%였다. 진피층은 치밀결합조직으로 주로 콜라겐 섬유로 구성되며, 섬유세포, 혈관, 색소포, 비늘이 관찰되었다.
This study describes the light microscopical cell types and histochemical characteristics as a preliminary study for the research on integument of the walleye pollock Gadus chalcogrammus in accordance with the physiological and environmental changes. The lateral line of the integument surface showed a curve in the anterior part and was straight from the middle to the posterior part. Integument is composed of outer epidermis and inner dermis. The epidermis is a stratified layer composed of epithelial cells, mucous cells, and club cells. Epithelial cells are classified into squamous superficial cell, cuboidal intermediated cell and columnar basal cell. The thickness of epidermis was 122.9 μm, and the ratio of epidermis thickness to body length was 0.03%. The mucous cell and club cell of unicellular gland were mainly distributed in the apical and middle layer of epidermis. The mucous cell contained mucosal materials of acidic glycoprotein. The proportion of mucous cells and club cells were 21.3 (± 7.0)% and 4.0 (± 1.0)% of epidermal area, respectively. The dermis was dense connective tissue layer and composed of mainly collagen fibers. It also contained fibrocytes, blood vessels, melanophores and scales.
Keywords: Gadus chalcogrammus(명태) Integument(피부) Light microscopy(광학현미경)
Correspondence to: Jung Sick Lee; Department of Aqualife Medicine, Chonnam National University, Yeosu 59626, Korea
This is an Open Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Language: Korean/English,
Full Text:

서 론
경골어류의 피부계는 외부 수서 환경에 직접 노출되어 수중의 물리, 화학, 생물학적 환경으로부터 자신을 보호하는 방어기능 및 삼투조절 등의 중요한 기능을 수행한다. 따라서 경골어류 피부계에서 상피층의 두께, 분비세포의 분포 정도 및 점액성상 등의 미세해부학적 구조는 종, 생활사 단계 및 서식생태에 따라 다양하다(Lee and Jin, 2001; Morrison et al., 2001; Faílde et al., 2014; Jeon et al., 2016; Lauder et al., 2016). 특히, 뱀장어 Anguilla japonica와 연어류인 Oncorhynchus sp.와 같은 회유성 어류의 경우에는 회유 경로에 따라 수온과 염분도와 같은 수서환경이 다르기 때문에 피부계의 구조와 기능적 변화의 폭은 더욱 크다(Park et al., 1995a, b; Robertson and Wexler, 1960).
명태 Gadus chalcogrammus는 대구목(Gadiformes), 대구과(Gadidae)에 속하는 냉수성 어류로서 수심 50~450 m에서 생활하며, 산란기는 12월에서 3월로 알려져 있으며 산란을 위해 근해로 이동하는 회유성 어류이다(Kim and Kang, 1998; Kim et al., 2005; Kang et al., 2013). 따라서 명태는 외양에서 근해로 산란회유 시 생리적인 변화와 함께 광범위한 해양 환경의 변화에 적응할 필요가 있으며, 생활사 단계에 따른 피부계의 구조적 차이를 보일 것으로 예상된다.
본 연구는 명태 피부계의 구조, 구성 세포 종류 및 조직화학적 특징의 기재를 통하여 이들의 환경적응 기작 연구의 기초자료를 제공하고자 하였다.
재료 및 방법
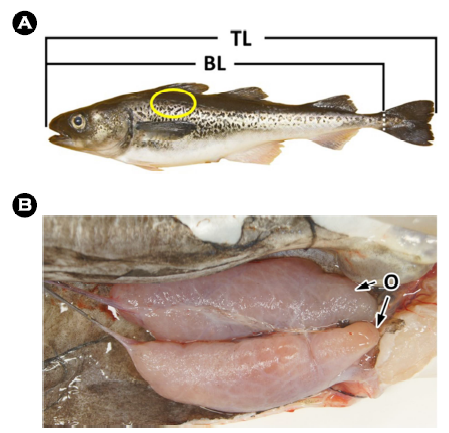
분석에는 2018년 12월 강원도 고성 연안에서 연승으로 채집한 평균 전장 50.1 (± 1.1) cm 크기의 10개체를 사용하였다(Fig. 1A). 계측형질을 측정하고 해부한 후 생식소를 육안으로 확인하여 성 성숙도를 판정하였으며, 본 연구에서는 일부 산란이 이루어진 암컷 개체를 분석하였다(Fig. 1B). 조직표본 제작용 시료는 두부의 후방 등쪽 부분의 피부계를 적출하여(Fig. 1A) 10% 중성포르말린에 고정한 후 파라핀 포매법을 이용하여 두께 5~6 μm의 횡단면 연속절편을 제작하였다. 제작된 조직표본은 Mayer's hematoxylin과 0.5% eosin (H-E)의 비교염색, Masson 삼중염색 및 alcian blue -periodic acid and Schiff's solution (AB-PAS, pH 2.5) 반응 및 aldehyde fuchsin-alcian blue (AF-AB, pH 2.5) 반응을 실시하였다.
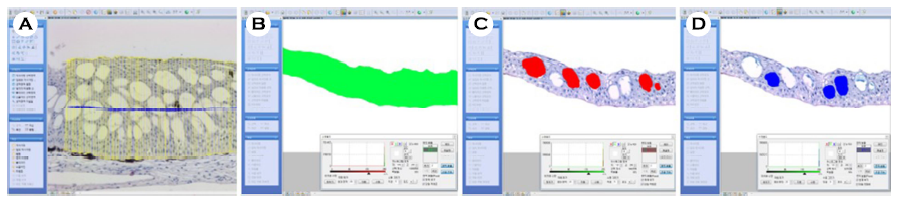
조직표본에서 상피층의 두께와 분비세포의 분포 비율은 현미경 화상분석장치(i-solution, IMT., U.S.A.)를 이용하여 분석하였다(Fig. 2). 체장에 대한 상피층 두께의 비율은 백분율(%)로 나타냈다.
결과 및 고찰
명태의 피부 표면의 측선(lateral line)은 전반부가 완만한 곡선형이었으며, 두 번째 등지느러미 아래쪽부터 꼬리지느러미 기저부까지는 직선으로 형성되어 있었다(Fig. 3). 측선공은 직경 약 589.6 ± 61.8 μm로 30~32개 관찰되었으며, 측선공 사이의 간격은 약 6.6 ± 0.9 mm였다. 어류의 측선은 물의 흐름과 압력 변화 등을 감지하는 중요한 감각기관 중 하나로 주로 머리와 몸통에 위치한다(Klein and Bleckmann, 2015). 측선의 형태는 종에 따라 다르며, 다음과 같이 여덟 가지 형태로 분류된다(Coombs et al., 1988; Webb, 2014a, b): 1) 직선형(complete-straight), 2) 아치형(complete -arched), 3) 등쪽배치형(dorsally placed), 4) 배쪽배치형(ventrally placed), 5) 불완전형(incomplete), 6) 분리형(disjunct), 7) 다수형(multiple), 8) 무측선형(absent). 이와 같은 기준으로 볼 때 명태의 측선은 제 2형으로 판단된다. 측선공의 수는 날붕장어 Echelus uropterus (TL 276.0~583.0 mm)는 43~50개 (Ji, 2011), 동갈돔과의 Apogon unicolor 26개(Han et al., 2022)로 종에 따른 차이를 보였다. 측선공의 크기 및 측선공 간 거리는 종에 따라 다르게 나타나며(Klein et al., 2011; Webb, 2014a, b), 측선공의 크기와 개수는 어류가 발달함에 따라 증가하지만, 치어기 이후에는 크기와 수가 안정화된다. 따라서 명태의 생활사에 따른 연구가 필요할 것으로 생각된다.

피부계는 조직학적으로 기저막을 중심으로 상피층과 진피층으로 구분된다. 상피층의 두께는 평균 122.9 μm, 체장에 대한 상피층 두께의 비율은 0.03%였다. 상피층은 13~20층으로 이루어진 다층 상피층으로 상피세포와 분비세포인 점액세포 및 곤봉세포들을 구분할 수 있었다(Fig. 4).
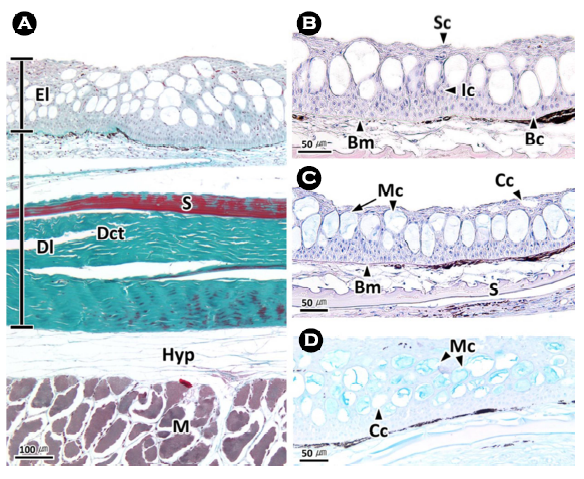
상피층은 상피세포의 형태에 따라 표면층, 중간층, 기저층으로 구분되는데, 표면층은 자유면 아래의 3~7층으로 주로 편평형 세포들로 이루어져 있었다. 중간층은 상피층의 가운데 부분으로 약 5~8층의 입방형 세포들로 구성되며, 기저층은 기저막에 인접한 세포층으로 약 5층의 원주형 세포로 구성되어 있었다(Fig. 4).
명태 피부계의 상피층과 진피층의 조직학적 구성은 학치과의 Lepadichthys lineatus (Fishelson, 1972), 가자미과의 Pleuronectes platessa (Roberts et al., 1972), 드렁허리과의 Monopterus cuchia (Mittal et al., 1980), 금붕어 Carassius auratus (Jeong and Moon, 1994), 연어과의 Salvelinus alpinus (Witkowski et al., 2004), 망둥어과의 Boleophthalmus dussumieri와 Periophthalmus waltoni (Dorostghoal et al., 2022)를 비롯한 많은 보고와 동일하였다.
해양 경골어류의 피부계 두께는 연안성 어류들이 유영력이 높은 외양성 어류들에 비해 두꺼운 것으로 보고되었으며, 이러한 이유는 연안 환경이 외양에 비해 수온, 염분도 및 유기물 농도 등의 환경 변화가 크고 이에 대한 어류의 방어기작과 연관이 있다(Lee and Jin, 2001). 현재까지 보고된 경골어류의 상피층 두께는 참복과의 Tetraodon fluviatilis 21.5 μm (Mittal and Banerjee, 1975), 넙치 Paralichthys olivaceus 42.3 μm (Lee and Jin, 2001; Kim et al., 2002), 베도라치 Pholis nebulsa 67.4 μm (Lee et al., 2000, Lee and Jin, 2001), 농어 Lateolabrax japonicus 35.9 μm, 조피볼락 Sebastes schlegeli 30.8 μm (Lee and Jin, 2001), 잿방어 Seriola dumerili 28.3 μm, 고등어 Scomber niphonius 20.4 μm, 삼치 Scombero- morus niphonius 12.7 μm, 갈치 Trichiurus lepturus 6.5 μm (Jin, 2004)로 외양성으로 유영력이 높은 어종일수록 상피층의 두께가 얇은 경향을 보였다. 회유성 어류인 Salvelinus alpinus의 피부 상피층 두께는 150.0~190.0 μm였으며(Witkowski et al., 2004), 산란기에 연안으로 회유하는 뚝지 Aptocyclus ventricosus 피부계 상피층은 약 30개의 상피세포들이 수직으로 구성된 다층 상피층으로 두께는 약 200 μm 내외로(Jeon et al., 2016) 본 연구와 유사하였다.
명태의 피부 상피층에서 표면층과 중간층에 주로 분포하는 점액세포는 단세포선으로 직경 약 39.9 ± 6.7 μm의 원형이었다. 이들은 H-E 염색(Fig. 4A)과 Masson 삼중염색(Fig. 4B)에서 공포상을 나타냈으며, AB-PAS (pH 2.5) 반응에서는 푸른색으로 반응하였고(Fig. 4C), AF-AB (pH 2.5) 반응에서는 연한 푸른색으로 반응하였다(Fig. 4D). 곤봉세포는 직경 약 38.0 ± 2.9 μm의 원형으로 상피층의 표면층과 중간층에 점액세포와 혼재하였으며, 점액세포와 마찬가지로 단세포선이었다. H-E 염색과 Masson 삼중염색, AB-PAS (pH 2.5) 반응, AF-AB (pH 2.5) 반응에서 모두 공포상을 나타냈다(Fig. 4). 현미경 화상분석 결과, 상피층에서 분비세포의 분포율은 약 25%였으며, 이 가운데 점액세포의 분포율은 21.3 (± 7.0)%로 곤봉세포의 4.0 (± 1.0)%에 비해 높은 분포율을 보였다.
경골어류 점액세포의 점액물질은 종에 따라 중성의 당단백질(An et al., 2007; Faílde et al., 2014; Jeon et al., 2016) 및 산성 당단백질(Pickering, 1974; Mittal and Banerjee, 1975; Eastman and Hikida, 1991; Jeong and Moon, 1994; Park et al., 1995b; Park and Kim, 1999)로 보고되었다. 본 연구에서의 점액세포는 AB-PAS (pH 2.5) 반응과 AF-AB (pH 2.5) 반응 결과, 산성의 당단백질을 함유하는 것으로 확인되었다.
분비선은 선을 구성하는 세포의 수에 따라 하나의 세포로 구성된 단세포선(unicellualr gland)과 분비기능을 가진 여러 개의 세포들로 구성된 다세포선(multicellular gland)으로 구분된다. 수서동물의 피부계는 본 연구의 명태를 비롯한 금붕어 C. auratus, 뱀장어 A. japonica, 넙치 P. olivaceus, 농어 L. japonicus, 잿방어 S. dumerili, 고등어 S. niphonius, 뚝지 A. ventricosus, 대구과의 Boreogadus saida 및 Gadus morhua 등 대부분의 경골어류에서 단세포의 부분분비선을 가지는 것으로 보고되어 있다(Jeong and Moon, 1994; Park et al., 1995b; Jin and Lee, 2005; Jeon et al., 2016; Ytteborg et al., 2020). 그러나, 복섬 Takifugu niphobles (An et al., 2007), 꾀장어과의 Eptatretus stoutii 및 Myxine glutinosa (Akat et al., 2022)는 단세포선과 다세포선이 혼재된 형태이며, 분비양상은 부분분비 및 전분비와 부분분비가 혼재된 형태를 가지고 있었다. 이러한 차이점은 어종에 따른 생태학적 측면을 고려한 추후의 연구가 필요할 것으로 생각된다.
해양 경골어류의 피부계에서 분비세포의 분포율은 넙치 P. olivaceus 11.6%, 베도라치 P. nebulas 19.2%, 농어 L. japonicus 3.9%, 조피볼락 S. schlegeli 5.0%, 잿방어 S. dumerili 8.6%, 고등어 S. japonicus 23.0%, 삼치 S. niphonius 3.6%, 갈치 T. lepturus 0.4%로 보고되었다(Lee et al., 2000; Lee and Jin, 2001; Kim et al., 2002; Jin, 2004). 분비세포의 분포율은 상피층의 두께와 마찬가지로 연안성 어류들이 외양성 어류들에 비해 높은 경향을 보였는데, 이러한 이유는 피부계 두께와 함께 연안의 높은 환경 변화에 대한 어류의 방어기작과 연관이 있다(Lee and Jin, 2001). 이러한 피부계의 구조적 차이는 서식생태와 유영력에 따라 어류의 환경적응 방법에 차이로 보인다. 유영력이 높은 외양성 어류는 환경 변화에 대하여 개체수준의 도피 반응을 보이는데 반하여 연안성 어류는 주로 세포수준의 적응기작을 보이는 것으로 판단된다.
대구과 어류인 Boreogadus saida와 Gadus morhua는 점액세포에 비해 곤봉세포의 크기가 약 3배 이상 큰 것으로 나타났으며(Ytteborg et al., 2020), 본 연구 결과와는 차이를 보였다. 이는 이들의 서식지와 생활사 단계에 따른 차이로 판단되지만, 추후 회유 경로에 따른 연구가 필요할 것으로 생각된다.
명태 피부계에서 교원섬유들로 이루어진 진피층은 치밀결합조직층으로 H-E 염색에서는 연한 분홍색으로 반응하며(Fig. 5A, D), Masson 삼중염색에서는 청록색으로 나타났으며(Fig. 5B), AB-PAS (pH 2.5) 반응에서는 연한 적자색으로 반응하였다(Fig. 5C). 기저막 아래의 진피층에는 진한 흑갈색으로 반응하는 색소포들이 기저막을 따라 분포하고 있었다. 또한 결합조직층 사이에서는 H-E 염색에서는 호산성으로 붉게 반응하며, Masson 삼중염색에서는 진한 적갈색으로 균질하게 반응하는 비늘과 호염기성으로 반응하는 미세과립상의 섬유세포들이 관찰되었다(Fig. 5B).
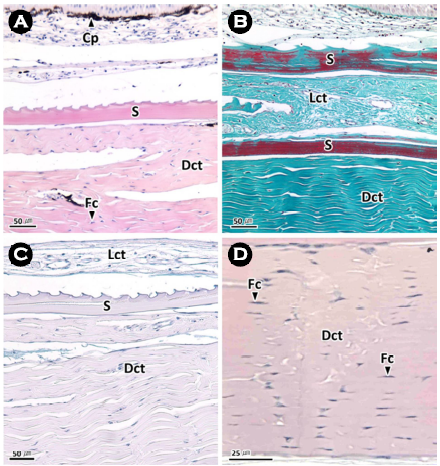
명태 피부계 진피층의 조직학적 특징은 연어류(Hawkes, 1974)를 비롯한 많은 경골어류 진피층과 동일하였다(Fujii, 1968; Kim et al., 2002; Arellano et al., 2004; Garg et al., 2010). 조직화학적 분석 결과, 메기목과의 Ancistrus dolichopterus는 H-E 염색에서 약한 호산성, AB 반응(pH 1.0 및 2.5)에서는 녹청색, PAS 반응에서는 자홍색, AB-PAS 반응에서는 보라색을 나타냈으며(Garg et al., 2010), 돌돔 Oplegnathus fasciatus는 AB-PAS (pH 2.5) 반응에서 alcian blue에 약한 양성반응을 나타냈다(Kim et al., 2004). 이러한 염색성의 차이는 결합조직층을 구성하는 성분의 차이로 판단되며, 이에 관해서는 종별 비교 분석이 필요할 것으로 판단된다.
- References
-
1. Akat E, Yenmiş M, Pombal MA, Molist P, Megías M, Arman S, Veselỳ M, Anderson R, Ayaz D. 2022. Comparison of verte- brate skin structure at class level: A review. Anat Rec 305: 3543-3608.
-
2. An CM, Kim JW, Jin YG, Park JJ, Lee JS. 2007. Ultrastructure and histochemistry on the integumentary system of the grass puffer, Takifugu niphobles (Teleostei: Tetraodontidae). Korean J Ichthyol 19: 201-209.
-
3. Arellano JM, Storch V, Sarasquete CJJOAI. 2004. Ultrastructural and histochemical study on gills and skin of the Senegal sole, Solea senegalensis. J Appl Ichthyol 20: 452-460.
-
4. Coombs S, Janssen J, Webb JF. 1988. Diversity of lateral line systems: evolutionary and functional considerations. Atema J, Fay RR, Popper AN, Tavolga WN (ed.), Sensory Biology of Aquatic Animals. Springer, New York, pp 553-593.
-
5. Dorostghoal M, Jazayeri A, Ashiri S. 2022. Histological study on the skin structure in two mudskippers, Periophthalmus waltoni and Boleophthalmus dussumieri in relation to their terrestrial life. Appl Microsc 52: 13.
-
6. Eastman JT, Hikida RS. 1991. Skin structure and vascularization in the Antarctic notothenioid fish Gymnodraco acuticeps. J Morphol 208: 347-365.
-
7. Faílde LD, Bermúdez R, Vigliano F, Coscelli GA, Quiroga MI. 2014. Morphological, immunohistochemical and ultrastructural characterization of the skin of turbot (Psetta maxima L.). Tissue Cell 46: 334-342.
-
8. Fishelson L. 1972. Histology and ultrastructure of the skin of Lepadichthys lineatus (Gobiesocidae: Teleostei). Mar Biol 17: 357-364.
-
9. Fujii R. 1968. Fine structure of the collagenous lamella underlying the epidermis of the goby, Chasmichthys gulosus. Annot Zool Jap 41: 95-106.
-
10. Garg TK, Domingos FXV, Almeida-Val VMF, Val AL. 2010. Histo- chemistry and functional organization of the dorsal skin of Ancistrus dolichopterus (Siluriformes: Loricariidae). Neotrop Ichthyol 8: 877-884.
-
11. Han S, Kim MJ, Song CB. 2022. First record of the big red cardinal- fish, Apogon unicolor (Apogonidae: Perciformes) from Korea. Korean J Ichthyol 34: 133-137.
-
12. Hawkes JW. 1974. The structure of fish skin: I. General organization. Cell Tissue Res 149: 147-158.
-
13. Jeon M, Kim H, Park JJ, Kim JW, Lee JS. 2016. Ultrastructure of in- tegument of the smooth lumpsucker, Aptocyclus ventricosus (Pallas, 1769) (Teleostei: Cyclopteridae). Korean J Ichthyol 28: 147-155.
-
14. Jeong YK, Moon MJ. 1994. Integumental secretory cells in goldfish, Carassius auratus L. Appl Microsc 24: 1-10.
-
15. Ji HS. 2011. Taxonomy and molecular phylogenetic study of the family Ophichthidae (Auhuilliformes) from the adjacent waters of Korea. Master's Thesis, Pukyong National University, Busan, pp 42.
-
16. Jin YG, Lee JS. 2005. Ultrastructure and histochemistry of the integumentary system of the chub mackerel, Scomber japonicus (Teleostei: Scombridae). Korean J Ichthyol 17: 98-104.
-
17. Jin YG. 2004. Study on structural biology of the integumentary system of oceanic teleost. Master's Thesis, Yeosu National University, Yeosu, pp 51.
-
18. Kang S, Park JH, Kim S. 2013. Size-class estimation of the number of walleye pollock Theragra chalcogramma caught in the southwestern East Sea during the 1970s-1990s. Korean J Fish Aquat Sci 46: 445-453.
-
19. Kim IS, Choi Y, Lee CL, Lee YJ, Kim BJ, Kim JH. 2005. Illustrated book of Korean fishes. Kyo-Hak Publishing Co., Seoul, pp 615.
-
20. Kim JW, Baeck GW, Baek HJ. 2004. Electron microscopic study on the integumentary epidermis of the parrot fish, Oplegnathus fasciatus. Appl Microsc 34: 131-137.
-
21. Kim JW, Chin P, Jin YG, Lee JS. 2002. Ultrastructure on the in- tegumentary epidermis of the bastard halibut, Paralichthys olivaceus (Teleostei: Pleuronectidae). Appl Microsc 32: 121-129.
-
22. Kim S, Kang S. 1998. The status and research direction for fishery resources in the East Sea/Sea of Japan. J Korean Soc Fish Res 1: 44-58.
-
23. Klein A, Bleckmann H. 2015. Function of lateral line canal morph- ology. Integr Zool 10: 111-121.
-
24. Klein A, Herzog H, Bleckmann H. 2011. Lateral line canal morph- ology and signal to noise ratio. Proc of SPIE 7975: 44-49.
-
25. Lauder GV, Wainwright DK, Domel AG, Weaver JC, Wen L, Bertoldi K. 2016. Structure, biomimetics, and fluid dynamics of fish skin surfaces. Phys Rev Fluids 1: 060502.
-
26. Lee JS, An CM, Huh SH. 2000. Integumentary ultrastructure of the blenny, Pholis nebulosa (Teleostei: Pholidae). J Korean Fish Soc 33: 148-152.
-
27. Lee JS, Jin YG. 2001. Structural difference of the teleost integument according to habitat. Bull Fish Sci Inst Yosu Univ 10: 1-7.
-
28. Mittal AK, Banerjee TK. 1975. Histochemistry and the structure of the skin of a murrel, Channa striata (Bloch, 1797) (Channi- formes, Channidae). I. Epidermis. Canada J Zool 53: 833-843.
-
29. Mittal AK, Whitear M, Agarwal SK. 1980. Fine structure and histo- chemistry of the epidermis of the fish Monopterus cuchia. J Zool 191: 107-125.
-
30. Mokhtar DM. 2022. Skin and associated sense structures, fish histology: from cells to organs. CRC Press, Boca Raton, pp 419.
-
31. Morrison CM, Miyake T, Wright Jr JR. 2001. Histological study of the development of the embryo and early larva of Oreochromis niloticus (Pisces: Cichlidae). J Morphol 247: 172-195.
-
32. Park IS, Kim JJ, Jo UB, Park SO. 1995a. Fine structural changes in the eel epidermis according to sea water adaptation. I. Epithelial cell. Korean J Zool 38: 26-37.
-
33. Park IS, Kim JJ, Jo UB, Park SO. 1995b. Fine structural changes in the eel epidermis according to sea water adaptation. II. Mucous cell and club cell. Korean J Zool 38: 38-47.
-
34. Park JY, Kim IS. 1999. Structure and histochemistry of skin of mud loach, Misgurnus anguillicaudatus (Pisces, Cobitidae), from Korea. Korean J Ichthyol 11: 109-116.
-
35. Pickering AD. 1974. The distribution of mucous cells in the epi- dermis of the brown trout Salmo trutta (L.) and the char Salvelinus alpinus (L.). J Fish Biol 6: 111-118.
-
36. Roberts RJ, Young H, Milne J. 1972. Studies on the skin of plaice (Pleuronectes platessa L.) 1. The structure and ultrastructure of normal plaice skin. J Fish Biol 4: 87-98.
-
37. Robertson OH, Wexler BC. 1960. Histological changes in the organs and tissues of migrating and spawning Pacific salmon (genus Oncorhynchus). Endocrinology 66: 222-239.
-
38. Webb JF. 2014a. Morphological diversity, development and evolu- tion of the mechanosensory lateral line system. Coombs S, Bleckmann H, Fay RR, Popper AN (ed.), The Lateral Line System. Springer, New York, pp 17-72.
-
39. Webb JF. 2014b. Lateral line morphology and development and implications for the ontogeny of flow sensing in fishes. Bleckmann H, Mogdans J, Coombs S (ed.), Flow Sensing in Air and Water. Springer, Berlin, pp. 247-270.
-
40. Witkowski A, Kaleta K, Kuryszko J, Kusznierz J. 2004. Histological structure of the skin of Arctic charr, Salvelinus alpinus (L.) from Spitsbergen. Acta Ichthyol Piscat 34: 241-251.
-
41. Ytteborg E, Hansen ØJ, Høst V, Afanasyev S, Vieweg I, Nahrgang J, Krasnov A. 2020. Morphology, transcriptomics and In vitro model of skin from polar cod (Boreogadus saida) and Atlantic cod (Gadus morhua). Fishes 5: 34.