JMLS 2023 December;8(2):150-159. 10.23005/ksmls.2023.8.2.150 Epub 2023 December 17
Copyright © 2023 by The Korean Society of Marine Life Science
Effects on Lethal Concentration 50%, Hematological Parameters and Plasma Components of Mirror carp, Cyprinus carpio nudus Exposed to Waterborne Nitrate
Yun-A Ryu; Department of Marine Life Sciences, College of Ocean Sciences, Jeju National University, Jeju 63243, Korea
Seul-Gi-Na-Ra Park; Department of Aquatic Life and Medical Science, Sun Moon University, Asan 31460, Korea
Jun-Hwan Kim; Department of Marine Life Sciences, College of Ocean Sciences, Jeju National University, Jeju 63243, Korea
- Abstract
수인성 질산 노출에 대한 향어의 독성 영향을 확인하기 위해 96시간 동안 0, 4, 20, 100, 500 및 2,500 mg NO3-/L의 수인성 질산에 노출을 실시하였다. 질산 96시간 급성 노출에 의한 향어의 반수치사농도(LC50)는 1,433.54 mg NO3-/L로 나타났다. 혈액학적 성상을 통해 수인성 질산 노출이 향어에게 미치는 생리학적 변화를 평가하였으며, RBC count는 유의적인 감소를 나타내었다(p < 0.05). 혈장 무기성분을 통해 수인성 질산 노출에 따른 향어의 이온 조절 능력 변화를 평가하였으며, 혈장 무기성분에서 calcium과 magnesium은 유의적으로 감소하였다(p < 0.05). 혈장 유기성분을 통해 수인성 질산 노출로 인한 향어의 건강도와 스트레스 상태를 평가하였으며, 혈장 유기성분인 glucose는 유의적인 증가를 나타내었다(p < 0.05). 혈장 효소성분을 통해 수인성 질산 노출로 인한 간 손상도 및 효소 활성의 변화를 평가하였으며, 혈장 효소성분인 AST, ALT 및 ALP는 높은 수준의 수인성 질산 노출에서 유의적으로 감소하였다(p < 0.05). 본 연구의 결과는 C. carpio nudus에 대한 수인성 질산 노출이 생존율, 혈액학적 성상 및 혈장성분에 독성으로 영향을 미칠 수 있음을 의미한다.
To determine the toxic effects of the mirror carp, Cyprinus carpio nudus on waterborne nitric acid exposure, they were exposed to waterborne nitric acid at 0, 4, 20, 100, 500, and 2,500 mg NO3-/L for 96 h. The semi-lethal concentration (LC50) of the scented fish by 96 hours of acute exposure to nitric acid was 1,433.54 mg NO3-/L. The physiological changes of waterborne nitric acid exposure on mirror carp were evaluated through hematologic properties, and RBC count showed a significantly decreased (p < 0.05). The change in the ion control ability of the mirror carp according to exposure to waterborne nitric acid was evaluated through the plasma inorganic component, and calcium and magnesium were significantly decreased (p < 0.05) in the plasma inorganic component. The health and stress status of the mirror carp due to exposure to waterborne nitric acid were evaluated through plasma organic ingredients, and the plasma organic component glucose showed a significantly increase (p < 0.05). Changes in liver damage and enzyme activity due to waterborne nitric acid exposure were evaluated through plasma enzyme components, the enzymatic activities of plasma AST, ALT, and ALP were significantly decreased (p < 0.05) in high levels of waterborne nitric acid exposure. The results of the present study suggest that waterborne nitric acid exposure to C. carpio nudus can toxicly affect survival, hematologic properties, and plasma components.
Keywords: Nitrate exposure(질산 노출) LC50(반수치사농도) Hematological parameters (혈액 성상) Plasma components(혈장성분) Mirror carp(향어)
Correspondence to: Jun-Hwan Kim; Department of Marine Life Sciences, College of Ocean Sciences, Jeju National University, Jeju 63243, Korea
- Received
- 13 November 2023;
- Revised
- 13 November 2023;
- Accepted
- 2 December 2023.
This is an Open Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Language: Korean/English,
Full Text:

서 론
질산은 수중 환경에서 수중생물의 대사산물, 배설물 및 폐사체와 같은 요인으로 인해 유기물이 무기물로 전환되며, 질산화 되는 과정의 최종산물이다(Shrimali and Singh, 2001). 또한 질산은 수중 생태계에서 용해된 무기 질소의 가장 흔한 이온 형태로, 대부분의 수중에서 적당한 농도로 존재하지만, 수산생물을 양식하는 양식장 환경에서 과도한 사료투입 또는 환수량 감소로 인해 급격히 증가할 수 있으며 이는 생물에게 영향을 미칠 수 있다(Camargo and Alonso, 2006). 특히, 산업 폐기물과 유기 비료의 과도한 사용은 수중 질산 오염의 주요한 원인이 될 수 있으며, 수중에 녹은 질산은 조류와 식물성 플랑크톤의 과도한 생산을 자극하여 부영양화를 유발할 수 있다(Alahi and Mukhopadhyay, 2018). 수중에 존재하는 질산은 자연적으로 소비 또는 분해되지만, 자연정화 능력을 초과한 지속적인 질산의 유입은 수중에 높은 질산염 축적을 유발할 수 있으며, 이는 수산생물에게 치명적인 영향을 미칠 수 있다(Nolan et al., 1998).
수중에 존재하는 높은 농도의 질산은 수중생물의 특정 조직에 축적을 일으키며, 주로 생리적으로 더 활성을 지닌 아가미, 간 및 신장에서 높은 수준으로 발견된다(Paul et al., 2019). 어류에서 지속적인 질산의 노출은 수중생물의 대사를 저하시키고, 사료효율을 감소시켜 원활한 성장을 억제시킨다(van Bussel et al., 2012). 만성적인 질산의 노출은 어류의 이상 유영 및 회피 반응의 감소와 같은 행동학적 변화를 초래하여 수중생물의 번식력을 저하시킬 수 있다(Gomez Isaza et al., 2020). 높은 수준의 질산은 어류 아가미를 통해서 체내로 급격히 유입되어 아가미 조직의 비대, 증생 또는 괴사와 같은 조직학적 변형을 일으키고, 이는 조직 형태의 변형을 통해서 기능 상실을 초래하여 어류의 산소 흡수 능력을 감소시킬 수 있다(Isaza et al., 2021; Rodgers et al., 2021). 질산에 지속적으로 노출된 어미 개체에서 산란된 치어의 경우, 조직의 초기 발달 및 분화 단계에 영향을 미쳐 정상적인 성장을 저해하고 기형을 유발할 수 있다(Ortiz-Santaliestra et al., 2006; Gomez Isaza et al., 2020).
질산은 어류에게 높은 독성을 유발할 수 있으며, 갑작스러운 질산의 노출은 어류의 항상성 붕괴와 조직 손상을 일으켜 짧은 시간에 대량 폐사를 초래할 수 있다(Bharati and Kumar, 2020). 반수치사농도(LC50, Lethal Concentration 50%)는 독성물질에 노출된 실험어가 50% 폐사를 일으키는 농도로, 독성물질에 대한 실험생물의 영향을 직접적으로 평가하기 위해 이용되며, 급성독성 노출 실험에서 생물의 내성한계를 확인하고 향후 만성독성 실험을 설계하기 위한 기준 농도를 설정하기 위해 활용될 수 있다(Singh and Manjeet, 2015). 반수치사농도의 수준은 독성의 정도를 의미하며, LC50의 수치가 높을수록 독성물질에 대한 영향이 상대적으로 낮음을 의미하고, 반대로 LC50의 수치가 낮을수록 독성물질의 영향이 높다는 것을 의미한다(Nekoubin et al., 2012).
어류의 혈액학적 성상은 이온 조절 및 생리 활성을 나타내는 핵심적인 지표이며, 독성물질의 노출에 따른 어류의 생리학적 변화를 평가하고 어류의 기능적 상태를 평가하는 지표로 사용된다(Latif et al., 2014). 어류의 혈액학적 성상은 종, 연령 및 성별과 같은 생물학적 요인에 의해서도 영향을 받을 수 있지만, 다양한 환경적 요인에 의해 더욱 직접적으로 영향을 받을 수 있다(Kohanestani et al., 2013). 높은 수준의 질산은 아가미 상피를 통해 어체로 들어가 혈액과 조직의 질산 수치를 증가시켜 혈중 산소 운반 능력을 저하시키고, 호흡기능 장애 및 삼투조절 교란 같은 생리 기능에 문제를 일으킬 수 있다(McGurk et al., 2006; Dutta et al., 2015). 또한 질산은 혈액 내에서 철 이온을 산화시킴으로써 헤모글로빈을 산소가 결합할 수 없는 형태인 메타헤모글로빈으로 전환시키고, 이는 적절한 산소 공급 부족에 의한 저산소증을 유발할 수 있다(Gomez Isaza et al., 2020).
향어(Cyprinus carpio nudus)는 저수지 및 댐 등의 깊은 곳이나 유속이 느린 곳에서 무리를 지어 서식하며, 조개류 및 조류 등을 주로 먹고 자라는 잡식성 어류이다(Heu et al., 2022). 향어는 일반 잉어보다 성장속도가 2.0~2.5배 정도로 빨라, 현재 우리나라를 포함하여 전 세계 여러 국가에서 많이 양식되고 있는 대표적인 내수면 어종이다(Li et al., 2007). 최근 고밀도로 사육되고 있는 양식장에서 질산은 매우 높은 수준으로 존재할 수 있으며, 이러한 내성한계를 넘어서는 질산의 존재는 양식생물의 대량 폐사를 유발할 수 있다(Monsees et al., 2017). 하지만, 질산 노출에 따른 향어의 내성한계 및 생리적 영향에 대한 독성연구는 거의 이루어지지 않고 있다. 따라서 본 연구의 목적은 수인성 질산 노출에 따른 반수치사농도, 혈액학적 성상 및 혈장성분의 변화를 확인하여, 질산 노출에 따른 독성 영향을 평가하고 독성 기준 지표를 제시하는 데 있다.
재료 및 방법
1. 실험어 및 실험 환경
본 실험에 이용된 향어(무게 16.6 ± 3.9 g, 전장 10.3 ± 0.7 cm)는 충남 아산 인근의 양식장에서 분양 받이, 실험 시작 2주 전부터 실험실 환경에서 순치를 실시하였다. 향어는 100 L 원형 수조에서 순치 기간 동안 매일 2회 식이 급여하였으며, 24.7℃, 8.08 ± 0.1 mg/L 및 pH 8.05 ± 0.6의 항시 일정한 상태로 유지되었다. 실험 수조는 30 L 유리 사각 수조를 이용하여 6개의 농도구간(0, 4, 20, 100, 500 및 2,500 mg NO3-/L)으로, OECD TG 203 (Fish Acute Toxicity Test)을 참고하여 96시간 급성 노출을 실시하였다. 농도구간은 질산 예비 노출 실험(100, 500, 2,500 mg NO3-/L)의 결과를 토대로 선정하였으며, 실험은 총 72마리(질산 농도구간 6개 × 실험구간 당 6마리 × 반복구 2개)를 이용하여 노출을 진행하였다. 본 연구에서 질산 노출은 질산칼륨(KNO3, Potassium Nitrate)를 이용하여 표준원액 60,000 mg NO3-/L를 만들었으며, 각 수조에 농도에 맞게 노출을 실시하였다.
2. 반수치사농도(LC50)
수인성 질산 노출에 의한 반수치사농도를 확인하기 위해, 질산 노출 후 0, 1, 3, 6, 12, 24, 48, 72 및 96시간 수조 별 폐사 유무를 확인하였으며, 폐사 개체는 관찰되는 즉시 제거해주었다. 96시간 후 질산 노출에 의한 최종 폐사 개체를 바탕으로 통계프로그램(SPSS Inc, Chicago, IL, USA, probit model)을 이용하여 반수치사농도 수치를 산출하였다.
3. 혈액성상
혈액학적 분석은 수인성 질산 노출 96시간 후 살아있는 개체를 이용하여 채혈을 실시하였다. 채혈은 헤파린(Sigma Chemical, St. Louis, MO, USA) 처리된 주사기를 사용하였으며, 채혈 직후 적혈구수(RBC count), 헤모글로빈(Hemoglobin), 적혈구 용적(Hemato- crit)을 즉시 분석하였다. Hemoglobin 수치는 임상용 kit (Asan Pharm. Co., Ltd)를 이용하여 Cyan-methemoglobin 법으로 측정하였다. Hematocrit는 모세관 내로 혈액을 넣어, Microhematocrit centrifuge (VS-12000, Korea)에서 12,000 rpm, 10분간 원심분리 후 Micro-hematocrit reader를 이용하여 측정하였다. RBC count는 Hendrick's diluting solution으로 혈액을 400배 희석 후, hemo-cytometer (Improved Neubauer, Germany)를 이용하여 광학현미경으로 계수하였다.
Hemoglobin, hematocrit 및 RBC count 결과를 바탕으로 평균적혈구용적(MCV: mean corpuscular volume), 평균적혈구혈색소량(MCH: mean corpuscular hemoglobin) 및 평균적혈구헤모글로빈농도(MCHC: mean corpuscular hemoglobin concentration)는 아래의 방식으로 산출하였다.
MCV (μL) = Hematocrit (%) / 적혈구수(106/ μL) × 10
MCH (pg) = Hemoglobin (g/dL) / 적혈구수(106/ μL) × 10
MCHC (%) = Hemoglobin (g/dL) / Hematocrit (%) × 100
4. 혈장성분 분석
수인성 질산 노출에 따른 혈장성분의 변화를 분석하기 위해 채취한 혈액을 4℃에서 3,000 x g으로 15분간 원심분리 후 혈장을 분리하였다. 혈장 무기성분으로 칼슘(Calcium), 마그네슘(Magne- sium)을 측정하였다. 칼슘은 OCPC법, 마그네슘은 Xylidyl blue-I 법에 따라 임상용 kit (Asan Pharm. Co., Ltd)를 이용하여 측정하였다. 혈장 유기성분으로 혈당(Glucose), 콜레스테롤(Cholesterol) 및 총 단백질(Total protein)을 측정하였다. 혈당은 GOD/POD법, 콜레스테롤은 비색법, 총 단백질은 Biuret법에 의해 시판되고 있는 임상용 kit (Asan Pharm. Co., Ltd)를 이용하였다. 혈장 효소 활성으로 AST (Aspartate aminotransferase), ALT (Alanine transaminase) 및 ALP (Alkaline phosphatase)를 측정하였다. AST와 ALT는 505 nm에서 Reitman-Frankel법, ALP는 King-King법으로 500 nm에서 임상용 kit (Asan Pharm. Co., Ltd)를 이용하여 분석하였다.
5. 통계분석 방법
본 실험분석은 수인성 질산 각 농도구간에서 6마리를 분석에 이용하였고, 모든 실험은 3반복 분석으로 이루어졌다. 실험분석 결과에 대한 통계학적 유의성은 SPSS 통계 프로그램(SPSS Inc.)을 이용하여 ANOVA test를 실시하여 Tukey's multiple range test를 통해 p < 0.05일 때 유의성이 있는 것으로 간주하였다.
결 과
1. 생존율 및 반수치사농도(LC50)
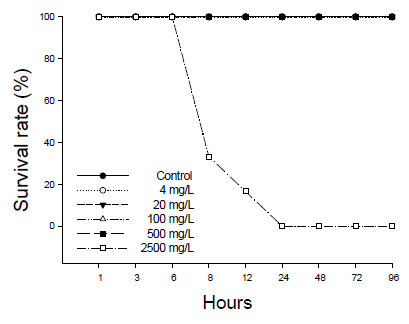
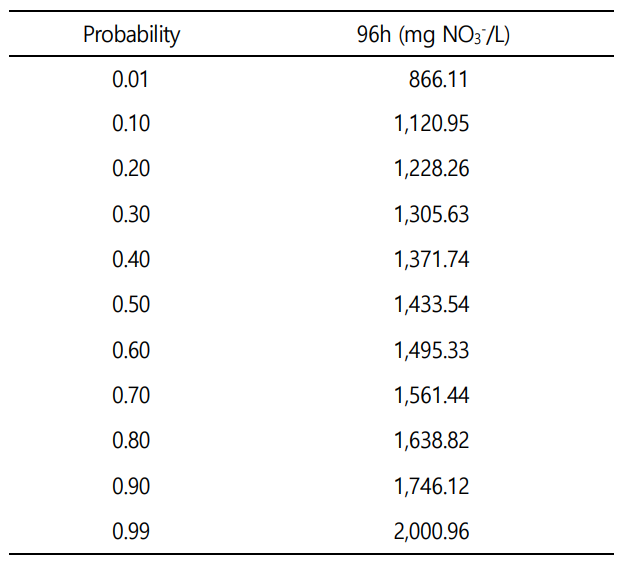
수인성 질산 노출에 따른 향어의 생존율은 Fig. 1에 나타내었다. 대조군 및 실험군 4, 20, 100, 500 mg NO3-/L의 질산 노출에서 폐사 개체는 발견되지 않았으며, 2,500 mg NO3-/L의 실험군에서는 노출 8시간부터 폐사가 발생하여 24시간에 100% 폐사가 나타났다. 수인성 질산 노출에 따른 향어의 반수치사농도(Lethal concentration 50, LC50)는 Table 1에 나타내었다. 수인성 질산 노출에 따른 향어의 반수치사농도는 1,433.54 mg NO3-/L로 나타났다.
2. 혈액학적 성상
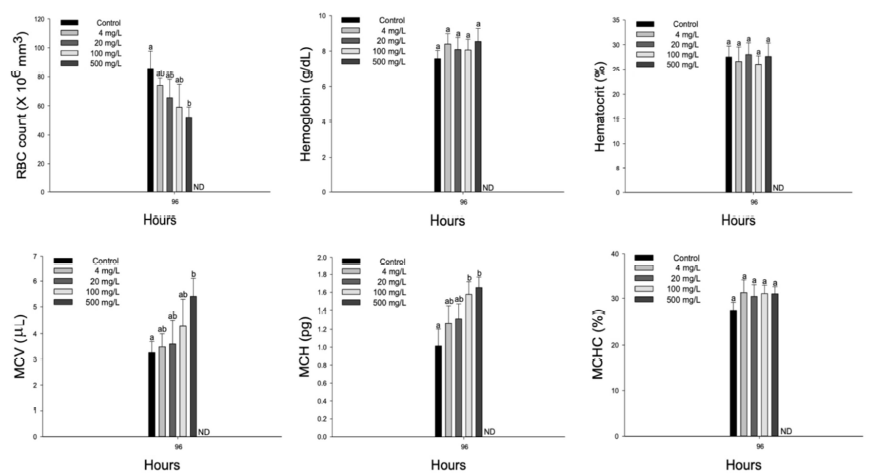
수인성 질산 노출에 따른 향어의 혈액학적 성상은 Fig. 2에 나타내었다. 향어의 hemoglobin concentration과 hematocrit value는 수인성 질산 노출에 의해 유의적인 변화는 나타나지 않았다. 하지만 RBC count는 질산 4 mg NO3-/L 이상의 농도에서 유의적으로 감소하였다(p < 0.05). Hemoglobin, hematocrit 및 RBC count 결과를 바탕으로 MCV (μL) 및 MCH (pg)은 수인성 질산 4 mg NO3-/L 이상의 농도에서 유의적으로 증가하였다(p < 0.05). 하지만, MCHC (%)는 수인성 질산 노출에 따른 유의적인 변화는 나타나지 않았다.
3. 혈장성분
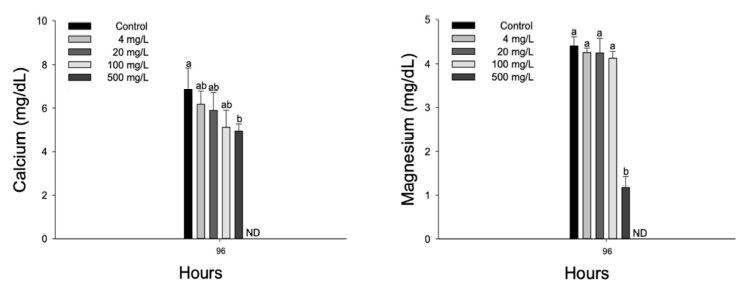
수인성 질산 노출에 따른 향어의 혈장 무기성분은 Fig. 3에 나타내었다. 혈장 calcium은 수인성 질산 4 mg NO3-/L 이상의 농도에서 유의적으로 감소하였으며(p < 0.05), 혈장 magnesium은 수인성 질산 500 mg NO3-/L 이상의 농도에서 유의적인 감소를 나타내었다(p < 0.05).
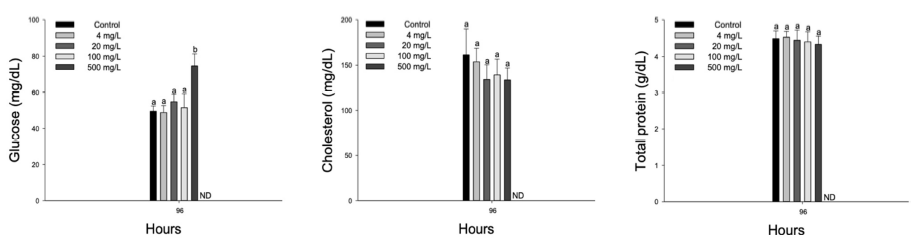
수인성 질산 노출에 따른 향어의 혈장 유기성분은 Fig. 4에 나타내었다. 혈장 glucose는 수인성 질산 500 mg NO3-/L 이상의 농도에서 유의적으로 증가하였으며(p < 0.05), 혈장 cholesterol 및 total protein에서 유의적인 변화는 나타나지 않았다.
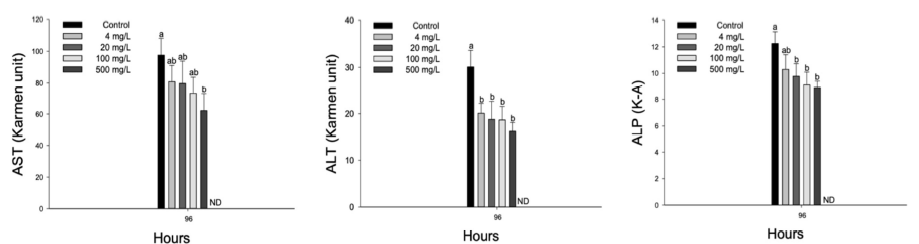
수인성 질산 노출에 따른 향어의 혈장 효소성분은 Fig. 5에 나타내었다. 혈장 AST, ALT 및 ALP는 4 mg NO3-/L 이상의 수인성 질산 노출에 의해 유의적으로 감소하였다(p < 0.05).
고 찰
수중 환경에서 높은 수준의 질산은 아가미의 상피 세포를 통해 혈액과 조직에 축적될 수 있으며, 이는 수중생물의 성장 저하, 발달 지연 및 저산소증 등의 독성으로 작용하여 대량 폐사를 유발할 수 있다(Romano and Zeng, 2007). 본 연구에서 수인성 질산 급성 노출은 향어에게 치명적인 독성으로 작용했으며, 수인성 질산 노출에 따른 96시간 반수치사농도는 1,433.54 mg NO3-/L로 나타났다. 일반적으로 양식장에서 측정되는 질산 농도는 125.81~ 151.86 mg/L(평균 136.77 ± 6.56 mg/L)이지만, 순환여과식 양식 시스템을 이용할 경우 매우 높은 농도의 질산 노출로 인해 어류의 대량 폐사가 발생할 수 있다(Jung et al., 2021). Iqbal et al. (2004)은 common carp, Cyprinus carpio(무게: 36.8 g, 전장: 15.3 cm)에서 수인성 질산의 96시간 급성 노출에 따른 반수치사농도는 865 mg NO3-/L으로 보고했다. 이는 질산이 어류의 신경계에 대해 독성으로 작용하여 이상 유영 및 과도한 점액 분비를 일으켰을 뿐만 아니라, 높은 수준의 질산이 신장 조직에 치명적인 손상을 초래하여 대량 폐사를 유발했다고 판단된다. Scott and Crunkilton (2000)은 96시간 질산 급성 노출에서 fathead minnow, Pimephales promelas 치어의 반수치사농도를 1,341 mg NO3-/L으로 보고하였으며, chinook salmon, Oncorhynchus tshawytscha(무게: 2.8~9.9 g, 전장: 6.7~10 cm), rainbow trout, Onchorhynchus, mykiss(무게: 2~8 g, 전장: 7.6~11.5 cm), channel catfish, Ictalurus punctatus(전장: 5~7.6 cm), guadalupe bass, Micropterus treculi(무게: 6.5 g)의 질산 급성 노출 LC50 값은 모두 1,250 mg NO3-/L에서 1,400 mg NO3-/L 범위에 속한다고 보고하였다. Seo et al. (2019)은 blackhead seabream, Acanthopagrus schlegelii 대상으로 수인성 질산의 96시간 급성 노출의 반수치사농도를 크기에 따라 관찰하였고, 어류의 크기가 커질수록 수인성 질산에 대한 내성이 상대적으로 높게 나타난다고 보고했다(무게: 7.1±0.6 g, 전장: 7.6 ± 0.9 cm: 2,505 mg NO3-/L, 무게: 71.3 ± 3.5 g, 전장: 16.1 ± 0.7 cm: 2,633 mg NO3-/L). 이는 치어 단계에서 독성물질에 대한 방어 시스템이 발달하지 못해 상대적으로 질산 노출에 더 민감하게 반응할 수 있으며, 어류가 성장함에 따라 다양한 환경 독성에 더 높은 내성을 보일 수 있다고 주장했다. Baker et al. (2017)는 질산 노출에 따른 독성 영향은 물의 경도에 따라서도 다르게 나타날 수 있다고 주장하였으며, O. mykiss의 수인성 질산의 96시간 급성 노출에 따른 반수치사농도는 연수(VSW, 10~15 mg/L as CaCO3)에서 808 mg NO3-/L, 경수(HW, 160~180 mg/L as CaCO3)에서 1,913 mg NO3-/L이라 보고했다. 이는 수중에 존재하는 염화물, 중탄산염 및 황산염과 같은 음이온이 질산과 경쟁적으로 흡수 작용을 일으켜, 질산 노출에 의한 독성 영향을 감소시킴에 따른 결과라고 주장했다. 질산 노출에 따른 수인성 질산의 내성한계는 생물의 종, 크기 및 연령과 같은 생물학적 특성 뿐만 아니라 수온, 염분, pH 및 경도와 같은 수질환경적 요인에 의해서도 차이가 발생할 수 있기 때문에, 질산 독성에 대한 광범위한 이해를 위해서는 다양한 조건 별 연구가 추가적으로 필요할 것이다.
혈액학적 성상은 질산 노출이 수중생물에게 미치는 여러 생리적 영향을 이해하는 지표로 사용되며, 독성 노출에 따른 어류의 건강 상태를 평가하는 지표이다(Yang et al., 2019). Abdel-Warith et al. (2020)는 African catfish, Clarias gariepinus의 질산 노출에서 RBC count, hemoglobin 및 hematocrit의 유의적 감소를 보고하였다. 이는 체내에 축적된 질산이 혈액 세포의 삼투압 불균형을 초래할 뿐만 아니라, 적혈구의 구조적 손상 및 용혈을 발생시켜 혈액학적 성상의 감소를 일으킨 결과로 판단된다. Gomez Isaza et al. (2021)는 질산 노출의 juvenile silver perch, Bidyanus bidyanus에서 hemoglobin과 hematocrit의 유의적 감소를 보고하였다. Yang et al. (2019) 역시 spotted parrot fish, Oplegnathus punctatus가 질산 노출에 의해 hemoglobin의 유의적 감소를 일으켰다고 보고하였다. 이는 질산의 독성 작용이 헤모글로빈을 메트헤모글로빈으로 산화시킴으로써 혈중헤모글로빈 농도를 감소시키고, 어류에게 과호흡 및 메트헤모글로빈혈증을 일으킬 수 있다. Adeyemo et al. (2008)는 급성 질산 노출에 의해 C. gariepinus에서 RBC count의 유의적 감소와 함께 MCV, MCH 및 MCHC의 유의적 증가를 보고하였다. 이는 질산 급성 노출이 RBC의 막구조를 손상시킨 것에 대한 직접적인 반응으로 해석되며, RBC count의 유의적 감소는 질산 노출로 인해 발생한 용혈 및 헤모글로빈 합성 방해에 대한 영향으로 판단된다. 본 연구에서 수인성 질산 급성 노출에 의한 향어의 hemoglobin과 hematocrit의 유의적 변화는 관찰되지 않았지만, RBC count는 유의적으로 감소하였다. Sherif et al. (2020) 역시 Nile tilapia, Oreochromis niloticus의 급성 질산 노출에서 적혈구 파괴 및 신생 적혈구 생성 저하로 인해 RBC count 감소가 일어날 수 있다고 보고하였다. 본 연구에서 수인성 급성 노출에 의한 향어의 MCV 및 MCH는 유의적 증가를 일으킨 반면, MCHC의 유의적 변화는 나타나지 않았다. Presa et al. (2022)도 급성 질산 노출에서 mullet, Mugil liza의 MCV 및 MCH의 증가를 보고하였다. 본 실험에서 나타난 MCV 및 MCH의 유의적 증가는 질산 노출로 인한 적혈구 세포의 부종에 의한 것으로 판단되며, Zulfahmi et al. (2021) 역시 질산 독성이 적혈구의 부종을 유발할 수 있다고 주장하였다. 급성 질산 노출에 따른 향어의 혈액학적 성상에 대한 변화는 제한적으로 나타났으며, 질산의 독성 작용이 일어난 일부 지표에서 유의적 변화가 나타났다. 이는 노출된 독성물질의 농도, 노출시간 및 생물학적 특성에 따른 결과이며, 수인성 질산 노출이 향어의 생리적 항상성에 손상을 유발함으로써, 본 연구에서는 RBC count의 선택적 감소가 일어난 것으로 판단된다.
혈장 무기성분인 calcium과 magnesium은 수중생물의 생리적 변화를 평가할 수 있는 지표이며, 세포막의 선택적 투과에 관여한다(Adedeji, 2010; Shi et al., 2022). Kim et al. (2017)은 sablefish, Anoplopoma fimbria에서 암모니아 노출에 의한 혈장 calcium과 magnesium의 유의적 감소를 보고하였으며, 이는 암모니아에 지속적으로 노출됨에 따라 어류의 이온 조절 능력에 장애가 발생한 결과라고 주장하였다. Azevedo et al. (2004)는 O. niloticus의 급성 아질산 노출에서 혈장 magnesium의 유의적 감소를 보고하였으며, 이는 아질산 독성에 의해 신장이 손상되었을 뿐만 아니라, 세뇨관 기능 이상으로 인해 magnesium 흡수가 정상적으로 이뤄지지 못한 결과라고 주장하였다. 본 연구에서 수인성 질산 급성 노출에 따른 향어의 혈장 무기성분 calcium과 magnesium은 유의적으로 감소하였으며, 이는 이온 조절 시스템이 손상되어 나타난 결과로 판단된다.
혈장 유기성분인 glucose는 어류의 중요한 에너지원이며, 독성 노출로 인한 어류의 스트레스 상태, 독성물질의 작용 방식 및 수생태계를 평가할 수 있는 주요 지표로써 널리 사용된다(Kavitha et al., 2010). Yu et al. (2021)는 turbot, Scophthalmus maximus에서 질산 노출에 의한 혈장 glucose의 유의적 증가를 보고하였다. 이는 질산이 어류 체내에 저산소증을 유발하여, 젖산 대사 활성화를 위해 혈액과 조직 내에 glucose가 축적된 결과로 판단된다. Schram et al. (2010)은 C. gariepinus의 암모니아 노출에서 혈장 glucose의 유의적 증가를 보고하였으며, 활성 암모늄 이온 배설 촉진을 위해 필요한 에너지가 증가함에 따라 혈장 glucose가 증가할 수 있다고 주장하였다. Hamlin et al. (2008) 역시 질산에 노출된 Siberian sturgeon, Acipenser baerii에서 혈장 glucose의 유의적 증가를 보고했다. 스트레스 환경에서 어류는 스트레스에 저항 및 극복하기 위해 필요한 에너지 요구량이 증가함에 따라, 간에서 glycogen 일부가 분해되어 혈중 glucose 증가를 유발할 수 있다(Datta and Kaviraj, 2003). 본 연구에서 수인성 질산 급성 노출에 따른 향어의 혈장 glucose는 유의적으로 증가하였으며, 이는 질산 노출 환경 요인에 대한 어류의 스트레스 적응 반응이라고 판단된다.
혈장 유기성분 중 cholesterol는 모든 스테로이드 호르몬 전구체의 주요 물질이며 어류의 지질 대사에 관여한다(Xu et al., 2022). 혈장 cholesterol 수치의 변화는 glucose와 같은 다른 혈장 유기성분에 의해 영향을 받는다(Walker et al., 2020). Sachar et al. (2015)은 cabdio morar, Aspidoparia morar에서 질산 노출에 의한 혈장 cholesterol의 유의적 증가를 보고하였으며, 이는 간 조직에 축적된 질산이 간 기능을 저하시킴으로써 조직의 정상적인 기능에 장애를 일으킨 결과라고 주장하였다. 반면 Zhang et al. (2021)은 Chinese perch, Siniperca chuatsi의 아질산 노출에서 혈장 choles- terol의 유의적 감소를 보고하였다. 이는 아질산 노출로 인해 손상된 간에 영양소가 축적되지 못함으로써 대사 활동 장애가 일어나, 혈장 cholesterol 감소를 유발할 수 있다고 주장하였다. Cholesterol은 스트레스 환경에서 에너지 생산 촉진을 위한 지질 합성 물질로 이용됨에 따라 감소할 수 있다(Abhay, 2013). 본 연구에서 수인성 질산 급성 노출에 따른 향어의 혈장 cholesterol의 유의적 변화는 관찰되지 않았으며, 이는 질산 노출에 따른 변화가 혈장 cholesterol에서 제한적으로 나타날 수 있음을 의미한다.
Total protein은 독성 노출에서 어류의 일반적인 건강 상태와 생물학적 변화를 판단하는데 주로 이용되는 생화학적 매개 변수이다(Lavanya et al., 2011). Sathya et al. (2012)는 Indian major carp, Cirrhinus mrigala의 급성 질산 노출에서 혈장 total protein의 유의적 감소를 보고하였으며, 이는 독성물질에 지속적으로 노출된 어류가 정상적인 생리활동을 유지하기 위해 단백질을 이용하여 소비한 에너지를 충족시킨 결과라고 주장하였다. Das et al. (2004)는 암모니아에 노출된 C. mrigala에서 혈장 total protein의 유의적 감소를 보고하였으며, 암모니아 독성에 의해 손상된 신장이 배설 장애를 일으켜, 혈장 단백질의 상당한 손실을 유발할 수 있다고 주장하였다. 하지만 본 연구에서 수인성 질산 급성 노출에 따른 향어의 혈장 total protein의 유의적 변화는 관찰되지 않았다.
혈장 효소성분 중 AST, ALT 및 ALP는 스트레스 조건에서 어류의 건강을 평가하는 주요 지표이며, 독성물질 노출에 의한 간 세포막 손상으로 인해 혈중으로 유출되어 일반적으로 증가되지만, 항상성 붕괴를 초래하는 독성 노출에 의해서는 고갈에 따른 감소가 나타날 수 있다(Palipoch et al., 2011; Copatti et al., 2019; Ghafarifarsani et al., 2021). Mary et al. (2015)는 급성 질산 노출에 의한 grass carp, Ctenopharyngodon idella의 혈장 AST 및 ALT의 유의적 감소를 보고하였으며, 조직 내에 축적된 질산이 효소 생성을 억제하고 어류의 대사활동 방해를 유발할 수 있다고 주장하였다. Ikeogu et al. (2004) 역시 C. gariepinus의 질산 노출에서 혈장 AST, ALT 및 ALP의 유의적 감소를 보고하였으며, 질산 독성이 간 세포막의 투과성 및 결합을 방해하고 혈장 효소 생성을 억제시켜, 어류에게 생화학적 장애를 일으킬 수 있다고 주장하였다. 본 연구에서 수인성 질산 급성 노출에 따른 향어의 혈장 효소성분 AST, ALT 및 ALP는 유의적으로 감소하였으며, 이는 질산 노출로 인한 조직 손상과 기능 장애가 일어남으로써 AST, ALT 및 ALP의 생성이 억제된 결과로 판단된다.
본 연구에서 고농도의 수인성 질산(> 2,500 mg NO3-/L) 급성 노출은 향어의 높은 폐사를 유발하였으며, 수인성 질산 노출에 따른 향어의 96시간 반수치사농도는 1,433.54 mg NO3-/L로 나타났다. 수인성 질산 급성 노출은 향어의 혈액학적 성상과 혈장성분에서 유의적 변화를 나타내었으며, 본 실험의 결과는 영향 농도 이상의 수인성 질산 급성 노출이 향어의 생존율에 직접적인 영향을 미칠 수 있으며, 혈액학적 성상 및 혈장성분에 변화를 초래할 수 있음을 확인하였다. 하지만 질산 노출에 따른 조건은 다양하게 나타날 수 있으며, 향후 다양한 환경조건에서의 질산 독성 연구를 통해 환경 요인 별 질산이 어류에게 미치는 독성 영향에 대해 추가적인 연구가 필요할 것이다.
- References
-
1. Abdel-Warith AWA, Younis ESM, Al-Asgah NA, Rady AM, Allam HY. 2020. Bioaccumulation of lead nitrate in tissues and its effects on hematological and biochemical parameters of Clarias gariepinus. Saudi Journal of Biological Sciences 27: 840-845.
-
2. Abhay DS. 2013. Comparative study of cholesterol alterations in a freshwater teleost fish, Amblypharyngodon mola exposure to heavy metals. The Bioscan Journal of Life Sciences 8: 1001-1003.
-
3. Adedeji OB. 2010. Acute effect of diazinon on blood plasma bio- chemistry in the African catfish (Clarias gariepinus). Journal of Clinical Medicine and Research 2: 1-6.
-
4. Adeyemo OK, Ajani F, Adedeji OB, Ajiboye OO. 2008. Acute toxicity and blood profile of adult Clarias gariepinus exposed to lead nitrate. The Internet Journal of Hematology 4.
-
5. Alahi MEE, Mukhopadhyay SC. 2018. Detection methods of nitrate in water: A review. Sensors and Actuators A: Physical 280: 210-221.
-
6. Azevedo M, Souza MM, Freire CA. 2004. Reversibility of deleterious effects of the pisciculture byproduct nitrite on cultured Nile tilapia (Oreochromis niloticus). Aquatic Living Resources 17: 19-23.
-
7. Baker JA, Gilron G, Chalmers BA, Elphick JR. 2017. Evaluation of the effect of water type on the toxicity of nitrate to aquatic organisms. Chemosphere 168: 435-440.
-
8. Bharati N, Kumar A. 2020. Effect of nitrates & nitrites on pond water ecology of Madhepura, Bihar. Biospectra Journal 15: 129-132.
-
9. Camargo JA, Alonso A. 2006. Ecological and toxicological effects of inorganic nitrogen pollution in aquatic ecosystems: a global assessment. Environment International 32: 831-849.
-
10. Copatti CE, Baldisserotto B, de Freitas Souza C, Garcia L. 2019. Protective effect of high hardness in pacu juveniles (Piaractus mesopotamicus) under acidic or alkaline pH: Biochemical and haematological variables. Aquaculture 502: 250-257.
-
11. Das PC, Ayyappan S, Jena JK, Das BK. 2004. Acute toxicity of ammonia and its sub-lethal effects on selected haemato- logical and enzymatic parameters of mrigal, Cirrhinus mrigala (Hamilton). Aquaculture Research 35: 134-143.
-
12. Datta M, Kaviraj A. 2003. Ascorbic acid supplementation of diet for reduction of deltamethrin induced stress in freshwater catfish Clarias gariepinus. Chemosphere 53: 883-888.
-
13. Dutta B, Sarma SR, Deka P. 2015. Lead nitrate toxicity on haemato- logical changes in a live fish species Channa punctatus (Bloch). J Int J Fish Aquat Stud 3: 196-198.
-
14. Ghafarifarsani H, Hoseinifar SH, Adorian TJ, Ferrigolo FRG, Raissy M, Van Doan H. 2021. The effects of combined inclusion of Malvae sylvestris, Origanum vulgare, and Allium hirtifolium boiss for common carp (Cyprinus carpio) diet: Growth per- formance, antioxidant defense, and immunological param- eters. Fish & Shellfish Immunology 119: 670-677.
-
15. Gomez Isaza DF, Cramp RL, Franklin CE. 2020. Living in polluted waters: A meta-analysis of the effects of nitrate and inter- actions with other environmental stressors on freshwater taxa. Environmental Pollution 261: 114091.
-
16. Gomez Isaza DF, Cramp RL, Franklin CE. 2020. Simultaneous exposure to nitrate and low pH reduces the blood oxygen-carrying capacity and functional performance of a freshwater fish. Conservation Physiology 8: coz092.
-
17. Gomez Isaza DF, Cramp RL, Franklin CE. 2020. Thermal acclimation offsets the negative effects of nitrate on aerobic scope and performance. Journal of Experimental Biology 223: jeb224444.
-
18. Gomez Isaza DF, Cramp RL, Franklin CE. 2021. Exposure to nitrate increases susceptibility to hypoxia in fish. Physiological and Biochemical Zoology 94: 124-142.
-
19. Hamlin HJ, Moore BC, Edwards TM, Larkin IL, Boggs A, High WJ, Main KL, Guillette LJ, Jr. 2008. Nitrate-induced elevations in circulating sex steroid concentrations in female Siberian sturgeon (Acipenser baeri) in commercial aquaculture. Aqua- culture 281: 118-125.
-
20. Heu MS, Kim YY, Choe YR, Park SY, Song HS, Choi JM, Kim JS. 2022. Sensory and Enzymatic Properties of Israeli Carp Cyprinus carpio as Affected by Size, Part and Commercial Value. Korean Journal of Fisheries and Aquatic Sciences 55: 1-9.
-
21. Ikeogu CF, Nsofor CI, Igwilo IO, Ngene AA. 2004. Haematological and serological responses of Clarias gariepinus to sublethal concentrations of lead nitrate. Bulletin of Environmental Contamination and Toxicology 73: 911-918.
-
22. Iqbal F, Qureshi IZ, Ali M. 2004. Histopathological changes in the kidney of common carp, Cyprinus carpio following nitrate exposure. J Res Sci 15: 411-418.
-
23. Isaza DFG, Cramp RL, Franklin CE. 2021. Thermal plasticity of the cardiorespiratory system provides cross-tolerance protection to fish exposed to elevated nitrate. Comparative Biochemistry and Physiology Part C: Toxicology & Pharmacology 240: 108920.
-
24. Jung HS, Shin BK, Bae JI, Han YT, Jeon BH, Kim YJ, Shin JA, Hwang SI. 2021. Environmental Evaluation of Pyropia Aquaculture Farm off Imja island in Shinan on the Southwest coast of Korea by Multivariate Analysis. Journal of Fisheries and Marine Sciences Education 33: 271-278.
-
25. Kavitha C, Malarvizhi A, Kumaran SS, Ramesh M. 2010. Toxico- logical effects of arsenate exposure on hematological, bio- chemical and liver transaminases activity in an Indian major carp, Catla catla. Food and Chemical Toxicology 48: 2848-2854.
-
26. Kim JH, Park HJ, Hwang IK, Han JM, Kim DH, Oh CW, Lee JS, Kang JC. 2017. Alterations of growth performance, hemato- logical parameters, and plasma constituents in the sablefish, Anoplopoma fimbria depending on ammonia concentrations. Fisheries and Aquatic Sciences 20: 1-6.
-
27. Kohanestani ZM, Hajimoradloo A, Ghorbani R, Yulghi S, Hoseini A, Molaee M. 2013. Seasonal variations in hematological parameters of Alburnoides eichwaldii in Zaringol Stream-Golestan Province, Iran. World Journal of Fish and Marine Sciences 5: 121-126.
-
28. Latif A, Khalid M, Ali M. 2014. Evaluation of toxic stress of copper sulphate and lead nitrate on hematological and serum bio- chemical characteristics of freshwater cyprinid (Labeo rohita). Int J Current Engg Technol 4: 366-372.
-
29. Lavanya S, Ramesh M, Kavitha C, Malarvizhi A. 2011. Hemato- logical, biochemical and ionoregulatory responses of Indian major carp Catla catla during chronic sublethal exposure to inorganic arsenic. Chemosphere 82: 977-985.
-
30. Li D, Kang D, Yin Q, Sun X, Liang L. 2007. Microsatellite DNA marker analysis of genetic diversity in wild common carp (Cyprinus carpio L.) populations. Journal of Genetics and Genomics 34: 984-993.
-
31. Mary SCH, Bhuvaneswari D, Anandan R. 2015. Biochemical and histopathological studies on lead nitrate induced toxicity in fresh water fish grass carp (Ctenopharyngodon idella).
-
32. McGurk MD, Landry F, Tang A, Hanks CC. 2006. Acute and chronic toxicity of nitrate to early life stages of lake trout (Salvelinus namaycush) and lake whitefish (Coregonus clupeaformis). Environmental Toxicology and Chemistry: An International Journal 25: 2187-2196.
-
33. Monsees H, Klatt L, Kloas W, Wuertz S. 2017. Chronic exposure to nitrate significantly reduces growth and affects the health status of juvenile Nile tilapia (Oreochromis niloticus L.) in recirculating aquaculture systems. Aquaculture Research 48: 3482-3492.
-
34. Nekoubin H, Gharedaashi E, Imanpour MR, Montajami S. 2012. Determination of LC50 of Lead Nitrate and Copper Sulfate in Caspian Roach (Rutilus rutilus caspicus). Walailak Journal of Science and Technology 9: 333-340.
-
35. Nolan BT, Ruddy BC, Hitt KJ, Helsel DR. 1998. A national look at nitrate contamination of ground water. Water Conditioning and Purification 39: 76-79.
-
36. Ortiz-Santaliestra ME, Marco A, Fernández MJ, Lizana M. 2006. Influence of developmental stage on sensitivity to ammo- nium nitrate of aquatic stages of amphibians. Environmental Toxicology and Chemistry: An International Journal 25: 105-111.
-
37. Palipoch S, Jiraungkoorskul W, Tansatit T, Preyavichyapugdee N, Jaikua W, Kosai P. 2011. Protective efficiency of Thunbergia laurifolia leaf extract against lead (II) nitrate-induced toxicity in Oreochromis niloticus. J Med Plant Res 5: 719-728.
-
38. Paul S, Mandal A, Bhattacharjee P, Chakraborty S, Paul R, Mukhopadhyay BK. 2019. Evaluation of water quality and toxicity after exposure of lead nitrate in fresh water fish, major source of water pollution. The Egyptian Journal of Aquatic Research 45: 345-351.
-
39. Presa LS, Neves GC, Maltez LC, Sampaio LA, Monserrat JM, Copatti CE, Garcia L. 2022. Acute and sub-lethal effects of nitrate on haematological and oxidative stress parameters of juvenile mullet (Mugil liza) in freshwater. Aquaculture Research 53: 3346-3357.
-
40. Romano N, Zeng C. 2007. Acute toxicity of sodium nitrate, potas- sium nitrate, and potassium chloride and their effects on the hemolymph composition and gill structure of early juvenile blue swimmer crabs (Portunus pelagicus Linnaeus, 1758) (Decapoda, Brachyura, Portunidae). Environmental Toxicology and Chemistry: An International Journal 26: 1955-1962.
-
41. Rodgers EM, Opinion AGR, Isaza DFG, Rašković B, Poleksić V, De Boeck G. 2021. Double whammy: nitrate pollution heightens susceptibility to both hypoxia and heat in a freshwater salmonid. Science of The Total Environment 765: 142777
-
42. Sachar A, Raina S, Gupta K. 2015. Stress of inorganic pollutant (Nitrate) Induced histopathological alterations in haemeo- poetic tissues of Aspidoparia morar. International Journal of Fisheries and Aquatic Studies 2: 07-11.
-
43. Sathya V, Ramesh M, Poopal RK, Dinesh B. 2012. Acute and sublethal effects in an Indian major carp Cirrhinus mrigala exposed to silver nitrate: Gill Na+/K+-ATPase, plasma elec- trolytes and biochemical alterations. Fish & Shellfish Immun- ology 32: 862-868.
-
44. Schram E, Roques JA, Abbink W, Spanings T, De Vries P, Bierman S, Vis H, Flik G. 2010. The impact of elevated water ammonia concentration on physiology, growth and feed intake of African catfish (Clarias gariepinus). Aquaculture 306: 108-115.
-
45. Scott G, Crunkilton RL. 2000. Acute and chronic toxicity of nitrate to fathead minnows (Pimephales promelas), Ceriodaphnia dubia, and Daphnia magna. Environmental Toxicology and Chemistry: An International Journal 19: 2918-2922.
-
46. Seo S, Choi EJ, Park J. 2019. Acute Nitrate Nitrogen Toxicity in Juvenile Blackhead Seabream Acanthopagrus schlegelii. Korean Journal of Fisheries and Aquatic Sciences 52: 268-273.
-
47. Sherif AH, Al-Sokary ET, Rizk WF, Mahfouz ME. 2020. Immune status of Oreochromis niloticus subjected to long-term lead nitrate exposure and a Arthrospira platensis treatment trial. Environmental Toxicology and Pharmacology 76: 103352.
-
48. Shi YC, Zhao YR, Zhang AZ, Zhao L, Yu Z, Li MY. 2022. Hexavalent chromium-induced toxic effects on the hematology, redox state, and apoptosis in Cyprinus carpio. Regional Studies in Marine Science 56: 102676.
-
49. Shrimali M, Singh KP. 2001. New methods of nitrate removal from water. Environmental Pollution 112: 351-359.
-
50. Singh BO, Manjeet K. 2015. Determination of LC50 of Lead Nitrate for a fish, Labeo rohita (Hamilton-Buchanan). International Research Journal of Biological Sciences 4: 23-26.
-
51. van Bussel CG, Schroeder JP, Wuertz S, Schulz C. 2012. The chronic effect of nitrate on production performance and health status of juvenile turbot (Psetta maxima). Aquaculture 326: 163-167.
-
52. Walker AM, Copatti CE, Melo FV, Melo JF. 2020. Metabolic and physiological responses to intraperitoneal injection of chro- mium oxide in hyperglycaemic Nile tilapia juveniles. Aqua- culture 517: 734821.
-
53. Xu Z, Zhang H, Guo M, Fang D, Mei J, Xie J. 2022. Analysis of Acute Nitrite Exposure on Physiological Stress Response, Oxi- dative Stress, Gill Tissue Morphology and Immune Response of Large Yellow Croaker (Larimichthys crocea). Animals 12: 1791.
-
54. Yang X, Peng L, Hu F, Guo W, Hallerman E, Huang Z. 2019. Acute and chronic toxicity of nitrate to fat greenling (Hexagrammos otakii) juveniles. Journal of the World Aquaculture Society 50: 1016-1025.
-
55. Yang X, Song X, Peng L, Hallerman E, Huang Z. 2019. Effects of nitrate on aquaculture production, blood and histological markers and liver transcriptome of Oplegnathus punctatus. Aquaculture 501: 387-396.
-
56. Yu J, Xiao Y, Wang Y, Xu S, Zhou L, Li J, Li X. 2021. Chronic nitrate exposure cause alteration of blood physiological parameters, redox status and apoptosis of juvenile turbot (Scophthalmus maximus). Environmental Pollution 283: 117103.
-
57. Zhang Y, Liang XF, He S, Li L. 2021. Effects of long-term low-concentration nitrite exposure and detoxification on growth performance, antioxidant capacities, and immune responses in Chinese perch (Siniperca chuatsi). Aquaculture 533: 736123.
-
58. Zulfahmi I, Rahmi A, Muliari M, Akmal Y, Paujiah E, Sumon KA, Rahman MM. 2021. Exposure to lead nitrate alters growth and haematological parameters of milkfish (Chanos chanos). Bulletin of Environmental Contamination and Toxicology 107: 860-867.