JMLS 2023 December;8(2):136-149. 10.23005/ksmls.2023.8.2.136 Epub 2023 December 17
Copyright © 2023 by The Korean Society of Marine Life Science
A Study on the Bioactivity Exploration of the Collected Marine Microorganisms and Microalgaes in Korea
Seung Sub Bae; Division of Marine Bio Industrialization, National Marine Biodiversity Institute of Korea, Seocheon 33662, Korea
Yong Min Kwon; Division of Marine Bio Industrialization, National Marine Biodiversity Institute of Korea, Seocheon 33662, Korea
Dawoon Chung; Division of Marine Bio Industrialization, National Marine Biodiversity Institute of Korea, Seocheon 33662, Korea
Woon-Jong Yu; Division of Marine Bio Industrialization, National Marine Biodiversity Institute of Korea, Seocheon 33662, Korea
Kichul Cho; Division of Marine Bio Industrialization, National Marine Biodiversity Institute of Korea, Seocheon 33662, Korea
Eun-Seo Cho; Division of Marine Bio Industrialization, National Marine Biodiversity Institute of Korea, Seocheon 33662, Korea
Yoon-Hee Jung; Division of Marine Bio Industrialization, National Marine Biodiversity Institute of Korea, Seocheon 33662, Korea
Yun Gyeong Park; Division of Marine Bio Industrialization, National Marine Biodiversity Institute of Korea, Seocheon 33662, Korea
Hyemi Ahn; Division of Marine Bio Industrialization, National Marine Biodiversity Institute of Korea, Seocheon 33662, Korea
Dae-Sung Lee; Division of Marine Bio Industrialization, National Marine Biodiversity Institute of Korea, Seocheon 33662, Korea
Jin-Soo Park; Natural Product Informatics Research Center, KIST Gangneung Institute of Natural Products, Gangneung 25451, Korea
Jaewook Lee; Natural Product Research Center, KIST Gangneung Institute of Natural Products, 25451 Gangneung, Korea
Dong-Chan Oh; College of Pharmacy, Seoul National University, Seoul 08826, Korea
Ki-Bong Oh; College of Agriculture and Life Science, Seoul National University, Seoul 08826, Korea
EunJi Cho; College of Agriculture and Life Science, Seoul National University, Seoul 08826, Korea
Sang-Ik Park; College of Veterinary Medicine, Chonnam National University, Gwangju 61186, Korea
You-Jin Jeon; Department of Marine Life Sciences, Jeju National University, Jeju 63243, Korea
Hyo-Geun Lee; Department of Marine Life Sciences, Jeju National University, Jeju 63243, Korea
Keun-Yong Kim; AquaGenTech Co., Ltd, Busan 48228, Korea
Sang-Jip Nam; Department of Chemistry and Nanoscience, Ewha Womans University, Seoul 03760, Korea
Hyukjae Choi; College of Pharmacy, Yeungnam University, Gyeongbuk 38541, Korea
Cheol Ho Pan; Microalgae Ask Us Co., Ltd, Gangneung 25441, Korea
Grace Choi; Division of Marine Bio Industrialization, National Marine Biodiversity Institute of Korea, Seocheon 33662, Korea
- Abstract
우리나라 여러 해양환경 지역으로부터 확보한 370주의 해양세균, 균류, 미세조류로부터 기초생리활성(항산화, 항염, 항균, 항암, 항바이러스)을 조사하여 채집지, 분리원, 종(種) 수준에서의 활성결과를 비교하였다. 해양세균의 경우, 일반적으로 유용성이 많이 알려진 Streptomyces 속과 Bacillus 속에 속하는 균주들이 두드러진 강한 효능이 관찰되었고, 주로 해양퇴적물로부터 유용한 자원을 분리할 수 있었다. 해양균류와 미세조류의 경우에도 종 특이적으로 활성이 강하게 나타나는 결과를 확인할 수 있었고, 효능 특이적으로 활성을 보이는 결과도 얻을 수 있었다. 이러한 결과를 바탕으로 추후 특정질병에 선택적으로 효능을 보이는 화학물질 연구 또는 자원 기반 연구 수행 시 유용성을 전제로 한 자원 확보 전략 수립과 산업 활성화를 위한 전략소재로 우선적 접근이 용이할 수 있는 연구결과라 생각된다. 또한, 이들 결과를 해양바이오 뱅크를 통한 분양소재로 활용함으로써 학계, 산업계에서 활용하여 해양바이오산업 활성화에 좀 더 빠른 접근을 도울 수 있다고 생각한다
Basic bioactivities (antioxidant, anti-inflammatory, antibacterial, anticancer, antiviral) were investigated from 370 strains of marine bacteria, fungi, and microalgae obtained from various marine environmental regions in Korea, and the activity results were obtained at the collection site, isolation source, and species level was compared. In the case of marine bacteria, strains belonging to the generally useful genera Streptomyces and Bacillus were observed to have particularly strong efficacy and useful resources were mainly isolated from marine sediments. In the case of marine fungi and microalgae, results showing strong species-specific activity were confirmed, and results showing efficacy-specific activity were also obtained. Based on these results, it is a research result that can facilitate priority access as a strategic material for industrial revitalization and the establishment of a strategy to secure resources based on usefulness when conducting research on chemicals that are selectively effective against specific diseases or when conducting resource-based research. In addition, we believe that by using these results as material for sale through the Marine BioBank (MBB), academia and industry can use them to help accelerate the revitalization of the marine bio industry.
Keywords: Marine bacteria(해양세균) Marine fungi(해양균류) Marine microalgae(해양 미세조류) Bioactivity(생리활성) Marine BioBank; MBB(해양바이오뱅크)
Correspondence to: Grace Choi; Division of Marine Bio Industrialization, National Marine Biodiversity Institute of Korea, Seocheon 33662, Korea
- Received
- 7 November 2023;
- Revised
- 9 November 2023;
- Accepted
- 16 November 2023.
This is an Open Access article distributed under the terms of the Creative Commons Attribution Non-Commercial License (http://creativecommons.org/licenses/by-nc/3.0/) which permits unrestricted non-commercial use, distribution, and reproduction in any medium, provided the original work is properly cited.
Language: Korean/English,
Full Text:

서 론
해양미생물과 미세조류는 해양 생태계의 중요한 구성 요소로서, 생태학적, 경제적 및 환경적 측면에서 큰 중요성을 가지고 있다. 생태학적으로 해양 식물성 플랑크톤은 광합성을 통하여 탄소를 흡수하고 산소를 생산하는 주요한 역할을 한다(Falkowski and Raven, 2007). 이를 통해 해양 생태계의 영양 공급망을 유지하고, 수중 광합성 작용은 지구 대기 중 이산화탄소 농도를 조절하는데 기여한다(Falkowski and Raven, 2007). 해양미생물과 미세조류는 양식산업에서도 매우 중요한 자원으로 활용되고 있다. 어류, 갑각류 및 양식조류의 사료로 사용되며, 이를 통해 해양 식물성 자원의 고갈 문제를 해결하고 지속 가능한 양식산업을 유지할 수 있다.
해양미생물과 미세조류는 높은 영양과 생장 촉진 특성을 가지고 있어, 양식생물의 성장과 건강을 촉진하는 데 중요한 역할을 한다(Guiry, 2012). 또한, 해양미생물과 미세조류는 신약 및 의약품 개발에 매우 유망한 자원이다. 이들은 다양한 화학물질을 생산하며, 항암제, 항균제, 항염증제 등의 의약품 개발에 사용될 수 있다(Petersen et al., 2019). 해양미생물은 생물 다양성과 대사 능력이 높은 특성을 가지고 있어, 암세포와 같은 병원체의 성장을 억제하는 데에도 활용될 수 있다(Mayer and Hamann, 2004; Faulkner, 2002; Blunt et al., 2015). 마지막으로, 해양미생물과 미세조류는 해양 생태계의 균형을 유지하는 데 핵심적인 역할을 한다. 이들은 해양 식물성 플랑크톤과의 조절적 상호작용을 통해 식물플랑크톤의 과잉증식을 제어하고, 해양생물 다양성과 생태계 안정성을 지원한다. 또한, 해양미생물은 해양 생태계의 영양 공급망을 조절하고, 생태계적 서비스를 제공하는 데 기여한다(Strom, 2008). 따라서, 해양미생물과 미세조류의 확보와 보전은 해양 생태계의 건강과 지속 가능한 양식산업, 의약품 개발 등 다양한 분야에서 중요한 역할을 수행하는데 필수적이다. 이를 위해 해양 자원의 지속 가능한 관리와 보호가 필요하며, 국제적인 협력과 정책적인 노력이 필요하다.
본 연구는 우리나라 여러 지역으로부터 확보한 해양유래 시료로부터 다양한 해양세균, 균류, 미세조류를 확보하여 이들의 대량증식 가능성을 검토 및 확인하여 추출한 뒤, 그들이 생산한 유용한 이차대사물질이 포함된 추출물을 대상으로 항산화, 항염, 항균, 항암, 항바이러스 효능을 조사하였다. 효능결과 기준에 따른 등급을 매겨 이들 자원의 유용성을 채집지역에 따른 환경적 차이, 종(種) 수준에서 결과를 분석하였다. 이러한 결과들은 추후 해양미생물과 미세조류를 기반으로 한 연구, 교육, 산업분야에서 유용한 기초자료로 이용될 수 있다고 믿는다.
재료 및 방법
1. 해양세균, 균류, 미세조류 확보
본 연구는 2021년 4월부터 2026년 12월까지 수행하는 사업으로, 본 연구의 내용은 2021년 4월부터 2022년 12월까지 수행한 연구결과이다. 우리나라 동서남해안, 제주도, 울릉도로부터 해수, 해양퇴적토, 해조류 등의 다양한 해양시료를 확보하여, 해양세균, 균류, 미세조류를 순수 분리하였다. 또한 해양시료 확보 시 환경오염이 심한 지역이거나 온도, 염도, pH 등이 일반적 지역과 상이한 특수 환경이거나 타 해양생물군에 서식하는 공생 자원을 확보하기 위하여 노력하였다.
해양세균은 해수, 퇴적토, 해양동물(홍합, 고등 등), 해양식물(잘피, 해홍나물, 미역, 청각, 부챗말 등) 등 다양한 국내 해양시료로부터 분리하였다. 해양동식물의 경우 멸균된 해수로 2~3회 세척 후 막자사발에 0.85% 생리식염수를 넣고 고르게 분쇄하였다. 분쇄된 시료는 0.85% 생리식염수 용액을 이용하여 연속 희석법으로 10-1 ~ 10-4배로 희석하여 ZoBell 한천배지(5 g peptone, 1 g yeast extract, 0.01g FePO4 and 1.5% agar per liter of 20% distilled water and 80% aged seawater, Kwon et al., 2014)에 도말한 후 25℃에서 3~5일 동안 배양하였다. 배양 후 색소, 모양 등 형태학적 특성에 따라 단일 콜로니(colony)를 선별하여 Marine agar 2216 한천배지(MA, Difco)에 도말한 후 순수 배양체를 얻을 때까지 2~3회 계대 배양하여 순수 분리하였다. 순수 분리된 균주는 20% (v/v) 글리세롤을 이용하여 -80℃에 보존하였다.
해양균류는 해수, 퇴적토, 해조류, 해양동물(바지락, 고등 등) 등 다양한 해양시료로부터 분리하였다. 해수의 경우 0.45 μm 막 필터(현대 마이크로)를 이용하여 해수를 거른 후, 멸균된 가위로 8등분한 필터를 분리배지(3%의 NaCl, 0.01% ampicillin, 0.01% streptomycin sulfate가 함유된 감자포도당한천배지(potato dextrose agar, PDA; BD)에 치상 후 20℃에서 7~14일간 배양하였다. 퇴적토의 경우 약 0.5 g의 퇴적토를 5 mL 멸균 증류수와 섞은 후, 이 중 100 μL를 분리배지에 도말하여 20℃에서 7~14일간 배양하였다. 해조류는 멸균수로 2~3회 세척 후 약 1 × 1 cm 크기로 잘라 분리배지에 올려 20℃에서 7~14일간 배양하였다. 해양동물의 경우 해양동물(고등, 조개 등)의 내장을 분리 및 분쇄하여 멸균 증류수에 10배 희석한 후, 이 중 100 μL를 분리배지에 도말하여 20℃에서 7~14일간 배양하였다. 분리배지에서 자란 균류의 각 집락은 새로운 감자포도당 한천배지에 도말하여 순수한 배양체를 얻을 때까지 계대 배양 하였다. 순수 분리된 균류의 배양체는 20% (v/v) 글리세롤을 이용하여 -80℃에 보존하였다.
해양미세조류는 연근해에서 확보된 해수로부터 도말법을 이용하여 확보하였다. 먼저 확보된 해수시료 50 mL를 2,000 × g에서 1분간 원심분리 한 이후 상층액 40 mL를 전동 피펫을 이용하여 위에서부터 따라 버리고, 남아있는 하층액을 잘 혼합하여 1.5%의 Bactor agar가 포함된 BG-11 및 F/2 한천배지에 100 μL를 고르게 도말하여 25℃에서 60 μmol m-2 s-1의 광도로 광주기 없이 20일간 배양하였으며, 이후 형성된 미세조류 집락(colony)을 취득하여 3회 반복 도말하여 박테리아 집락으로부터 완전히 분리시킨 후 미세조류 배양체를 최종적으로 확보하였다. 이후 25 cm2 Cell Culture Flask (SPL Life Sciences, 대한민국)에 25 mL의 총 용량으로 미세조류를 각각 BG-11 및 F/2 배지에 접종하여 위와 동일한 조건으로 광배양 하여 배양체를 보존하였다.
2. 해양세균, 균류, 미세조류의 종(種) 동정
해양세균은 MA 한천배지에서 순수 분리된 각 균주의 콜로니를 10 mM TE 용액 100 μL에 넣어 95℃에서 5분 동안 열처리 후 10 μL의 시료, 16S rRNA 증폭은 27f (5'-AGAGTTTGATCMTGGC- TCAG-3')와 1492R (5'-TACGGYTACCTTGTTACGACTT-3') 프라이머와 유전자 증폭 Premix (Enzymomics, Korea)를 혼합하여 콜로니 PCR (Colony PCR)을 수행하였다. PCR 산물은 ExoSAP-IT PCR product Cleanup Reagent (Thermo Fisher)를 사용하여 정제 후, 염기서열분석기(Applied Biosystems 3730XL)를 이용하여 분석하였다. 각 균주의 16S rRNA 유전자 염기서열은 EzBioCloud (ezbiocloud.net/ identify)와 NCBI (https://blast.ncbi.nlm.nih.gov/Blast.cgi) 데이터베이스 BLAST 검색을 통해 표준 균주들과 상동성을 비교하여 가장 근접한 종들의 염기서열을 확인하였다. 각 균주에서 확인된 근접종의 염기서열들은 MEGA X software (Kumar et al., 2018)를 이용하여 계통수(phylogenetic tree)를 그려 계통분류학적 분석을 통해 동정하였다.
해양균류는 20 mL의 감자포도당배지(potato dextrose broth, PDB; BD)에서 28℃, 150 rpm 조건으로 3일간 배양을 통해 균사체를 확보하였다. 기존 문헌에서 제시한 방법에 따라 약사발을 이용하여 균사체를 분쇄한 후 phenol : chloroform:isoamyl alcohol (25:24:1; Sigma-Aldrich)을 이용하여 gDNA를 확보하였다(Chung et al., 2019). 균주 별로 actin (ACT-512F: 5'-ATGTGCAAGGCCGGTTTC- GC-3'/ACT-783R: 5'-TACGAGTCCTTCTGGCCCAT-3'), β-tubulin (bt2a: 5'-GGTAACCAAATCGGTGCTGCTTTC-3'/bt2b: 5'-ACCCTCAGTGTAGT- GACCCTTGGC-3'), calmodulin (CF1: 5'-GCCGACTCTTTGACYGARGAR-3')/CF4: 5'-TTTYTGCATCATRAGYTGGAC-3'), tef-1α (EF1: (5'-ATGGG- TAAGGARGACAAGAC-3'/EF2: 5'-GGARGTACCAGTRATCATGTT-3'), ITS (ITS1: 5'-TCCGTAGGTGAACCTGCG-3'/ITS4: 5'-TCCTCCGCTTATTGA- TATGC-3'), gpd (gpd1: 5'-CAACGGCTTCGGTCGCATTG-3'/gpd2: 5'-GCCAAGCAGTTGGTTGTGC-3'), LSU (LR0R: 5'-ACCCGCTGAACTTAA- GC-3'/LR5: 5'-TCCTGAGGGAAACTTCG-3') 유전자 프라이머를 사용하여 PCR을 수행한 후 유전자 마커의 염기서열을 확보하여 계통 분석을 실시하였다.
미세조류는 광학현미경 이미징 분석을 통한 형태학적 분석과 유전계통학적 분석을 동시에 수행하여 동정하였다. 먼저 광학현미경 이미징 분석을 위해 미세조류 배양액 10 μL를 취득하여 2% Lugol's solution (v/v)으로 고정하였으며, Slide glass에 배양체를 분주한 후 Cover glass로 덮고 Olympus BX50 (Olympus, 일본)을 이용하여 이미징 분석을 수행하였다. 이후 미세조류의 계통유전학적 분석을 위해 균주 별로 18S rRNA (Euk-A: 5'-CTGGTTGATC- CTGCCAGT-3')/Euk-B: 5'-GATCCTTCYGCAGGTTCACCTAC-3'), 16S rRNA (BAC-16S-1492f2: 5'-AGAGTTTGAWCMTGGCTCAG-3'/BAC-16S-1492r2: 5'-GYTACCTTGTTACGACTT-3'), rbcL (RYf2-CHL-PL-0001f: 5'-ATGGYWCCDCAAACWGAAAC-3')/YRr2-CHL-PL-1375r: 5'-TTRAT- YTCTTTCCAHACYTCACA-3') 유전자 프라이머를 이용하여 증폭하였으며, 각 유전자 부위의 염기서열을 확보하여 계통 분석을 실시하여 미세조류를 최종적으로 동정하였다.
3. 해양세균, 균류, 미세조류의 대량 배양과 추출물 제조
해양세균과 균류의 경우, 계대 배양을 통한 균주 배양에서 1 L 기준으로 7일 동안 배양 후, 배양된 균주 동량의 ethyl acetate 유기 용매 또는 XAD-7 고체 흡착 레진을 이용하여 흡착하여 acetone 용매로 용출시킨 용매 추출물을 감압농축기를 이용하여 농축하였다. 제조된 추출물은 추출물 보관 전용 용기에 담아 -80℃에서 보관하였다.
해양미세조류의 스케일업과 대량 배양을 위해 미세조류 배양액을 먼저 중간 단계인 1 L 규모의 Erlenmeyer flask를 이용하여 공기를 주입하며, 60 μmol m-2 s-1의 흰색 LED 빛을 공급하여 25°C에서 광배양을 진행하였으며, 이후 20 L 규모의 판넬식(panel) 또는 컬럼(column)형 광생물반응기(PhotoBioReactor, PBR)를 이용하여 초기 접종량을 104 ~ 106 cells mL-1의 농도로 처리하여 동일한 조건에서 10~20일간 배양을 진행하였다. 이후 5,000 rpm에서 원심분리를 통해 세포를 회수하였으며, 동결건조 후 약 1 g에 해당하는 미세조류 바이오매스를 1 L의 70% 에탄올(ethanol)을 이용하여 추출하였고, 감압농축기를 이용하여 농축하여 추출물 보관 용기에 담아 -80°C에서 보관하였다.
4. 기초생리활성(항산화, 항염, 항균, 항암, 항바이러스) 조사
총 370주의 추출물을 대상으로 기초생리활성을 조사하기 위하여 항산화 실험으로 2,2-diphenyl-1-picryl-hydrazyl-hydrate (DPPH) 와 2,2’-Azino-bis (3-ethylbenzothiazoline-6-sulfonic acid (ABTS) 라디칼 소거 효능 조사와 RAW264.7 macrophage를 이용한 reactive oxygen species (ROS) 소거 효능을 조사하였다. 항염증 실험으로 nitric oxide (NO) 생성 억제 효능과 prostaglandin E2 (PGE2) 생성 억제 효능을 조사하였다. 항균활성 실험으로는 6개의 병원성 세균에 대하여 minimum inhibitory concentration (MIC)을 실시하였다. 항암 효능을 위하여 7개의 암세포에 대하여 암세포 성장 억제 효능을 조사하였고, 3종의 바이러스를 대상으로 항바이러스 효능을 조사하였다. 자세한 각 생리활성 실험방법은 아래와 같다.
4.1. 항산화 효능 분석
항산화 실험으로 DPPH, ABTS 라디칼 소거 효능 조사와 대식세포(macrophage)를 이용한 ROS 소거 효능을 조사하였다. DPPH assay는 Blois 실험방법(Blois, 1958)을 변형하여 아래와 같이 분석하였다. 양성대조군은 α-tocopherol, Trolox, ascorbic acid을 di- methyl sulfoxide (DMSO)에 용해시켜 20 μg mL-1의 농도로 처리하고 370주의 추출물은 25, 50, 100, 200, 400 μg mL-1의 농도로 처리한 후 96-well plate에 제조한 추출물 및 대조군을 각각 100 μL씩 분주 후, 각 well에 0.15 mM DPPH 100 μL씩 분주하여 암실에서 30분간 상온에서 반응 후, microplate reader기를 이용하여 517 nm에서 흡광도를 측정하였다. DPPH 라디칼 소거 효능 계산식은 아래와 같다.
DPPH 라디칼 소거 효능(%) ={1-(추출물 처리군(O.D.) 값/음성대조군(O.D.) 값)} × 100
ABTS 실험은 Re et al.의 실험방법에 따라 수행하였다(Re et al., 1999). 양성대조군은 α-tocopherol을 dimethyl sulfoxide (DMSO)에 용해시켜 40 μg mL-1의 농도로 처리하였다. 370주의 추출물은 25, 50, 100, 200, 400 μg mL-1의 농도로 처리하였다. 96-well plate에 제조한 추출물 및 대조군을 각각 100 μL씩 분주 후, 각 well에 ABTS 100 μL씩 분주하여 암실에서 30분간 상온에서 반응 후, microplater reader기를 이용하여 734 nm에서 흡광도를 측정하였다. ABTS 라디칼 소거 효능 계산식은 아래와 같다.
ABTS 라디칼 소거 효능(%) ={1-(추출물 처리군(O.D.) 값/음성대조군(O.D.) 값)} × 100
RAW 264.7 macrophage를 이용한 활성산소(ROS) 소거능 실험은 CCK-8 assay를 통하여 세포 생존률을 먼저 확인하였다. 양성대조군은 α-tocopherol을 dimethyl sulfoxide (DMSO)에 용해시켜 40 μg mL-1의 농도로 처리하였다. 추출물은 50 μg mL-1의 농도로 처리하였다. Lipopolysaccharide (LPS)는 증류수에 용해시켜 제조 후, DMEM 배지에 희석하였다. 세포 생존률을 위한 LPS 처리 농도는 μg mL-1으로 하였다. 96-well plate에 RAW 264.7 macrophage를 3 × 105 cells mL-1로 100 μL씩 분주 후, 24시간 동안 배양하였다. 배양배지는 10% FBS가 포함된 DMEM 배지와 온도 37℃ CO2 5% 배양기에서 배양하였다. 세포 배양배지 제거 후 새로운 배지 80 μL와 추출물 10 μL를 분주 후, 다시 30분간 같은 조건에서 배양 후, 각 well에 제조한 LPS를 10 μL씩 분주하였다. 이때 음성대조군은 배지 10 μL를 분주하였다. 24시간 다시 배양 후, 각 well에 CCK-8 시약 10 μL씩 분주 후, 2시간 반응한 뒤, microplate reader를 이용하여 450 nm에서 흡광도를 측정하였다. 세포 생존률 계산은 아래와 같다.
세포 생존률(%) =(추출물 처리군(O.D.) 값/LPS 처리군(O.D.) 값) × 100
세포 내 ROS 소거 효능은 dichlorodihydrofluorescein-diacetate (DCFH-DA) assay를 통하여 수행하였다. 양성대조군은 α-tocopherol을 dimethyl sulfoxide (DMSO)에 용해시켜 40 μg mL-1의 농도로 처리하였다. 추출물은 10, 25, 50, 100 μg mL-1의 농도로 처리하였다. LPS는 증류수에 용해시켜 제조 후, DMEM 배지에 희석하여, 처리 농도는 1 μg mL-1으로 하였다. 96-well plate에 RAW 264.7 macrophage를 3 × 105 cells mL-1로 100 μL씩 분주 후, 24시간 동안 배양하였다. 배양배지는 10% FBS가 포함된 DMEM 배지와 온도 37℃ CO2 5% 배양기에서 배양하였다. 세포 배양배지 제거 후 새로운 배지(5 μM CM-H2DCFHDA 포함) 80 μL씩 분주 후 30분간 배양하였다. 각 well에 제조한 추출물을 10 μL씩 분주 후, 다시 30분간 같은 조건에서 배양하였다. 각 well에 제조한 LPS를 10 μL씩 분주(음성대조군은 배지 10 μL 분주) 후 24시간 다시 배양한 후에 Fluorescence microplate reader를 이용하여 492/525 nm에서 흡광도를 측정하였다. ROS 소거 효능 계산은 아래와 같다.
ROS 소거 효능(%) ={1-(추출물 처리군(O.D.) 값/LPS 처리군(O.D.) 값)} × 100
4.2. 항염 효능 분석
LPS를 이용하여 염증을 유발시킨 RAW 264.7 macrophage에서의 일산화질소(nitric oxide, NO) 저해 효능과 Prostaglandin E2 (PGE2) 저해 효능을 관찰하였다. NO와 PGE2 저해 효능을 분석하기 앞서 RAW 264.7 macrophage에서의 세포독성은 앞서 실행한 DCFH-DA assay 전, 세포독성 실험과 같은 방법으로 수행하였다. NO 저해 효능 분석은 12-well plate에 RAW 264.7 macrophage를 3 × 105 cells mL-1로 1 mL씩 분주 후, 24시간 동안 배양하였다. 배양배지는 10% FBS가 포함된 DMEM 배지와 온도 37℃ CO2 5% 배양기에서 배양하였다. 세포 배양배지 제거 후 새로운 배지 800 μL와 추출물(10, 25, 50, 100 μg mL-1)을 100 μL씩 분주 후, 30분간 같은 조건에서 배양하였다. 각 well에 제조한 LPS를 100 μL씩 분주(음성대조군은 배지 100 μL 분주) 후 24시간 다시 배양한 후에 각 well 내 세포 배양액 회수 후 1.5 mL tube에 분주하였다. 13,000 rpm에서 1분간 4℃에서 원심분리를 수행 후, 새로운 1.5 mL tube에 상층액 900 μL를 회수하였다. Nitrite standard는 N-(1-napthyl) ethylenediamine dihydrochloride와 sulfanillic acid 1:1 (v:v)로 혼합하여 DMSO 용해시켜 제조하였다. 150 μL nitrite standard와 세포 배양액 150 μL에 각각 증류수 130 μL와 Griess reagent 20 μL씩 분주하고 30분간 상온에서 반응시켰다. Fluores- cence microplate reader를 이용하여 548 nm에서 흡광도를 측정하였다.
NO 저해 효능(%) ={1-(추출물 처리군(O.D.) 값/LPS 처리군(O.D.) 값)} × 100
PGE2 저해 효능은 enzyme-linked immunosorbent assay를 수행하였다. 추출물은 10, 25, 50, 100 μg mL-1의 농도로 처리하였으며, PGE2 standard는 15.63, 31.25, 62.5, 125, 250, 500 pg mL-1로 제조하였다. 마찬가지로 12-well plate에 RAW 264.7 macrophage를 3 × 105 cells mL-1로 1 mL씩 분주 후 24시간 동안 배양하였다. 배양배지는 10% FBS가 포함된 DMEM 배지와 온도 37℃ CO2 5% 배양기에서 배양하였다. 세포 배양배지 제거 후 새로운 배지 800 μL와 추출물(10, 25, 50, 100 μg mL-1)을 100 μL씩 분주 후, 30분간 같은 조건에서 배양하였다. 각 well에 제조한 LPS를 100 μL씩 분주(음성대조군은 배지 100 μL 분주) 후 24시간 다시 배양한 후에 각 well 내 세포 배양액 회수 후 1.5 mL tube에 분주하였다. 13,000 rpm에서 1분간 4℃에서 원심분리를 수행 후, 새로운 1.5 mL tube에 상층액 900 μL를 회수하였다. 100 μL PGE2 standard와 세포배양액 100 μL에 각각 conjugate 50 μL와 antibody 50 μL씩 분주 후 24시간 동안 4℃에서 반응시켰다. Washing buffer 400 μL 분주를 통한 3회 washing 후 substrate solution 200 μL 분주 후, 37℃에서 1시간 반응시켰다. Stop solution 50 μL 분주 후, Fluorescence microplate reader를 이용하여 405 nm에서 흡광도를 측정하였다.
PGE2 저해 효능(%) ={1-(추출물 처리군(O.D.) 값/LPS 처리군(O.D.) 값)} × 100
4.3. 항균 효능 분석
370개의 추출물 시료를 대상으로 세균 6종(Staphylococcus aureus ATCC 6538, Bacillus cereus ATCC 10876, Enterococcus faecalis KCTC 3511, Salmonella typhimurium ATCC 14028, Escherichia coli KCTC 2571, Pseudomonas aeruginosa KCCM 11321)에 대한 항균 효능 분석을 최소발육저지농도 시험(minimum inhibitory concen- tration test, MIC test)를 수행하였다. 모든 시료에 대하여 3반복 수행하였으며, 배지 Müller-Hinton broth에 연속희석법으로 농도 구배를 준 샘플과 대상 균주 5 × 105 CFU mL-1를 함께 접종하여 35±2℃에서 16~20시간 배양한 뒤 control well 성장량과 비교하여 80% 이상 균 성장이 억제된 end point를 MIC 값으로 결정하였다.
4.4. 항암 효능 분석
7종의 암세포(위암, AGS; 폐암, A549; 대장암, HCT116; 간암, HepG2; 유방암, MCF-7; 피부암, HT-1080; 혈액암, HL60)의 세포증식 및 생존성을 정량적으로 비교하여 추출물의 항암 효능을 측정하였다. WST-1 assay는 살아있는 세포의 수와 정비례하는 미토콘드리아 탈수소효소의 활성을 이용하여 tetrazolium salt가 분해되는 과정에서 생성되는 formazan을 정량 분석하는 방법으로 수행하였다. 추출물은 10% DMSO를 이용하여 측정에 사용할 농도(1, 5, 10 mg mL-1)를 제조하였다. 시약은 WST-1 assay kit (abcam, #ab65473)를 이용하여 제조사에서 제시하는 protocol에 따라 수행하였다. 7개의 암세포주를 이용하여 아래와 같은 조건으로 배양 후, 96-well plate에 seeding하여 분석하였다. 추출물을 100 μg mL-1 농도로 처리 후 24~48시간 동안 배양하였다. 10 μL WST-1/ ECS 용액(well 당 배양액 100 μL 기준)을 처리 후 0.5~4시간 동안 반응시켰다. 반응이 끝난 96-well plate를 1분 동안 교반 후, spectrophotometer를 이용하여 440 nm에서 흡광도를 측정하고 아래와 같이 항암 효능 계산을 하였다.
항암 효능(%) = {1-(추출물 처리군/비처리군)} × 100
스크리닝 단계에서는 단일농도 100 μg mL-1로 처리, 이후 우수 후보물질(항암활성 40% 이상)에 대하여 1~100 μg mL-1로 다양한 농도로 처리하여 IC50를 측정하였다.
4.5. 항바이러스 효능 분석
3종의 바이러스 (Influenza A virus H1N1, Porcine epidemic diarrhea virus (PEDV) QIAP1401 및 Human hepatitis A virus (HAV) HM175/18f)에 대한 세포독성 효과 및 항바이러스 효과를 측정하였다. 각 추출물에 대한 CC50, IC50, SI (selectivity index) 값을 구하였으며, 분석을 위해 SI 값을 양성대조군(chloroquine)과 비교하였다. Cytopathic 저해 효능은 CPE inhibition assay를 수행하였다. 96-well plate에 각 숙주세포를 1 × 105 cells well-1로 분주 후 24시간 배양하였다. 각 바이러스를 0.01 MOI (multiplicity of infection) 으로 접종하여 1시간 동안 세포에 흡착 후, 남은 바이러스액을 제거한 후 새로운 배지(추출물 포함) 분주 후 72시간 동안 배양하였다. 각 well에 5 mg mL-1 MTT 시약 분주 후 4시간 동안 배양하였다. 각 well의 배양약을 제거하고 각 well 마다 destaining solution 100 μL씩 분주 후, microplate reader를 이용하여 570~650 nm에서 흡광도를 측정하여 세포변성 효과 저해 효능을 계산하였다.
저해 효능(%) = (추출물 처리군(O.D) 값 - 감염, 비투여 대조군 (O.D) 값)/(비감염, 비투여 대조군 (O.D) 값 - 감염, 비투여 대조군 (O.D) 값) × 100
각 바이러스에 대한 독성은 MTT assay를 수행하였다. 96-well plate에 각 숙주세포는 1 × 105 cells well-1로 분주 후 24시간 배양하였다. 세포가 monolayer가 되면 세포 배양배지 제거 후 새로운 배양배지(추출물 포함) 분주 후 72시간 배양하였다. 각 well에 5 mg mL-1 MTT 시약 분주 후 4시간 배양하였다. 각 well의 배양약을 제거하고 각 well 마다 DMSO 100 μL씩 분주 후 microplate reader를 이용하여 570~650 nm에서 흡광도 측정을 하였다. 세포독성 계산식은 아래와 같다.
Cytotoxicity (%) ={1-(추출물 처리군(O.D) 값/비처리군(O.D) 값)} × 100
결 과
1. 순수 분리한 해양유래 미생물과 미세조류
2021년 4월부터 2022년 12월까지 우리나라 서해, 동해, 남해 연안에서 해수, 해양퇴적토, 해양생물 등 다양한 해양 자원으로부터 해양세균 230주, 해양균류 70주, 해양미세조류 70주를 순수 분리하여 총 370주를 확보하였다.
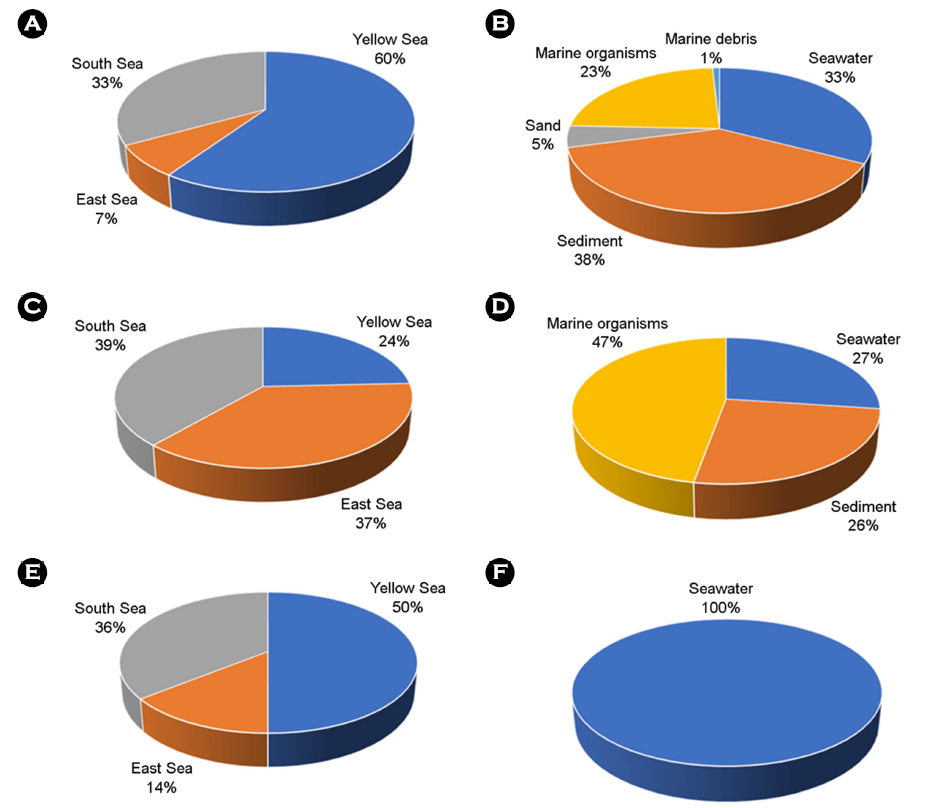
해양세균은 2021년도에 80주, 2022년도에 150주로 총 230주를 순수 분리하였으며, 우리나라 연안 별로 서해(60%), 남해(33%), 동해(7%) 연안지역 순으로 서해 연안지역에서 확보한 해양세균이 가장 높은 비율을 차지하며 분리원 별로 해양퇴적토(38%), 해수(33%), 해양생물(23%), 해양모레(5%), 해양쓰레기(1%) 조성으로 해양퇴적물과 해수 시료에서 주로 순수 분리하여 해양세균을 확보하였다(Fig. 1A and B). 순수 분리된 해양세균은 16S rRNA 유전자 염기서열 정보를 이용하여 EzBioCloud와 NCBI에서 표준 균주와 상동성을 비교하여 계통분류학 분석을 통해 동정하였고, 순수 분리된 해양세균은 국립해양생물자원관 해양바이오뱅크(https://www.mbris.kr/biobank/main/index.do)에 등록하였다(MABIK MI00006249-MI00006328, MABIK MI00006704-MI00006853).
해양균류는 2021년도에 20주, 2022년도에 50주로 사업 기간 동안 총 70주를 확보하였다. 우리나라 연안 별로 남해 연안지역에서 분리한 해양균류가 가장 높은 비율을 차지하며 분리원 별로 해양생물(47%), 해수(27%), 해양퇴적물(26%), 조성으로 해양생물에서 주로 순수 분리하여 해양균류를 확보하였다(Fig. 1C and D). 확보된 균주들은 유전자 마커 염기서열(actin, β-tubulin, calmo- dulin, tef-1α, ITS, gpd, LSU)을 이용한 계통 분석을 통해 동정하였고, 국립해양생물자원관 해양바이오뱅크에 등록하였다(MABIK FU00000715, MABIK FU00001117-1135, MABIK FU00001180-1229).
해양 미세조류는 채취된 해수로부터 2021년도에 20주, 2022년도에는 50주로 총 70주를 확보하였다. 우리나라 연안 별로 서해(50%), 남해(36%), 동해(14%) 연안지역 순으로 영양염류가 풍부한 서해와 남해에서 확보된 미세조류가 많았으며, 서해 또는 남해 중에서도 염분이 높은 해수 및 염전지역과 더불어 해수와 담수의 중간 정도의 염분을 가진 기수(brackish water) 지역에서도 다양한 미세조류들을 확보하였다(Fig. 1E and F). 확보된 균주들은 현미경 이미지를 활용한 형태학적 특성 분석과 유전자 염기서열의 계통 분석을 통해 동정하였다. 이후 확보된 미세조류는 국립해양생물자원관 해양바이오뱅크에 등록하였다(MABIK LP00000149-168, MABIK LP00000185-234).
2. 해양유래 미생물과 미세조류 종(種) 다양성
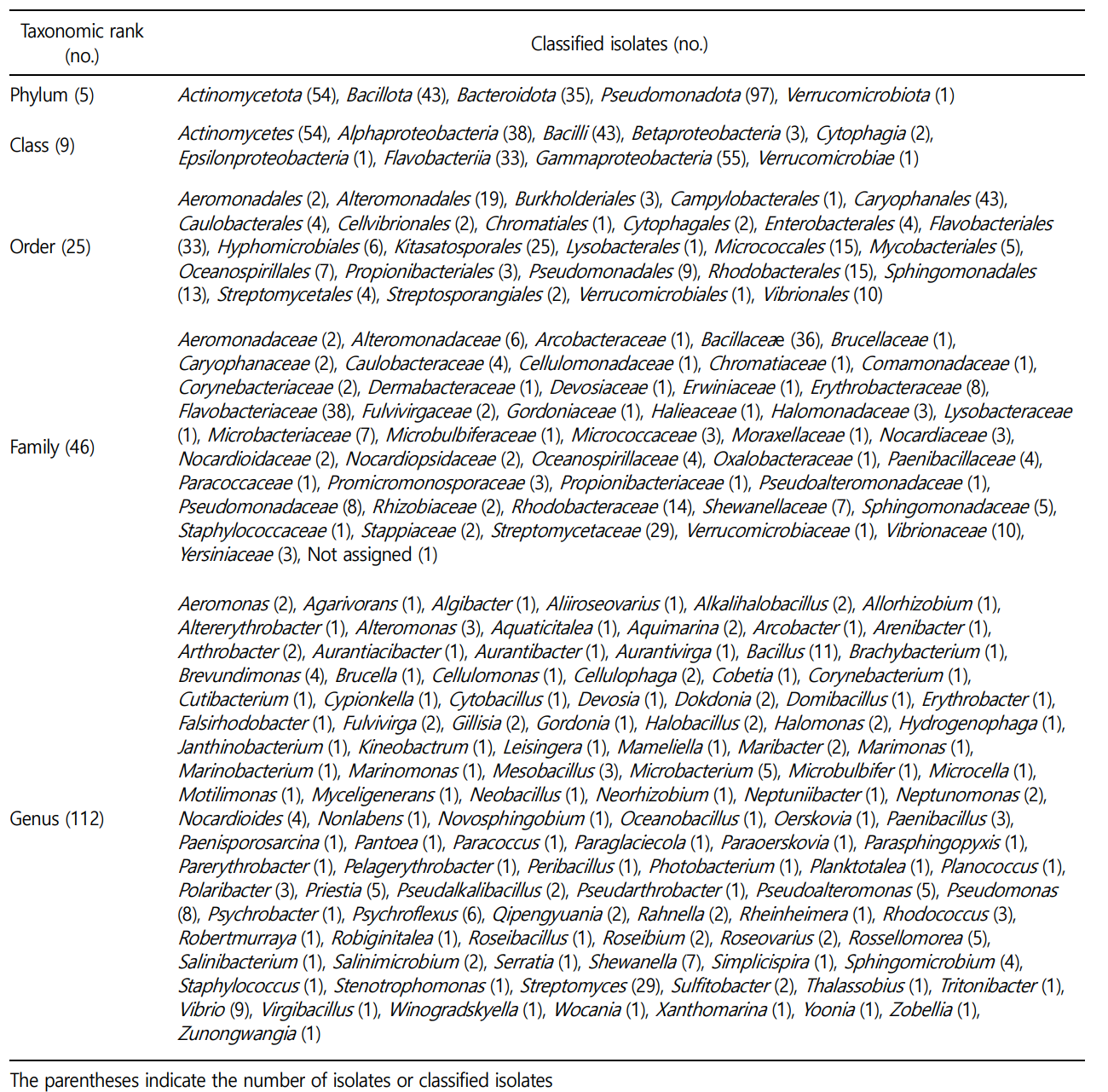
순수 분리된 해양세균 230주는 EzBioCloud 및 NCBI 데이터베이스 검색을 통해 표준 균주와 염기서열 상동성을 비교하여 계통수를 분석한 결과, 5문(phylum), 9강(class), 25목(order), 46과(family). 112속(genus)으로 확인되었다(Table 1). 대부분의 균주는 Pseudomonadota 문에 속했고(97주), 그 다음으로는 Actinomy- cetota(54주), Bacillota(43주), Bacteroidota(35주), Verrucomicrobiota (1주) 문에 해당되었다. 강에 속하는 균주의 경우, Gammaproteo- bacteria(55주), Actinomycetes(54주), Bacilli(43주), Alphaproteo- bacteria(38주), Flavobacteriia(33주) 순으로 5종류의 강에 속하는 균주들이 약 97%를 차지하였다. 목에 속하는 균주의 경우, Caryo- phanales(43주), Flavobacteriales(33주), Kitasatosporales(25주), Altero- monadales(19주), Micrococcales(15주), Rhodobacterales(15주), Sphingomonadales(13주), Vibrionales(10주) 순으로 8종류의 목에 속하는 균주들이 약 75%를 차지하였다. 과에 속하는 균주의 경우, Bacillaceae(36주), Flavobacteriaceae(38주), Streptomycetaceae(29주), Rhodobacteraceae(14주), Vibrionaceae(10주) 순으로 5종류의 과에 속하는 균주들이 약 53%를 차지하였다. 속에 속하는 균주의 경우, Streptomyces와 Bacillus 균주가 각각 29주(약 13%)와 11주(약 5%)로 가장 많은 수를 차지하였다.
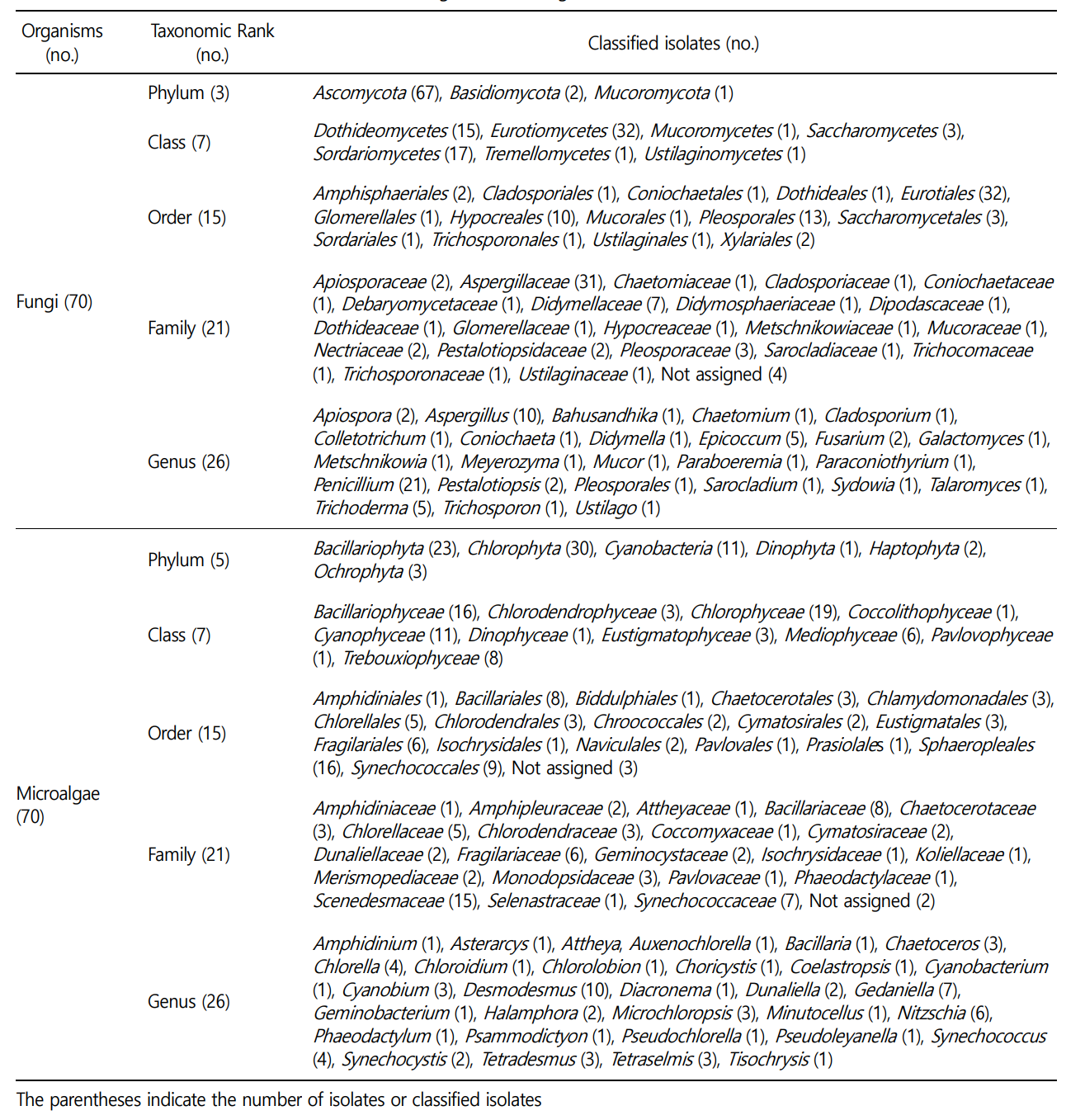
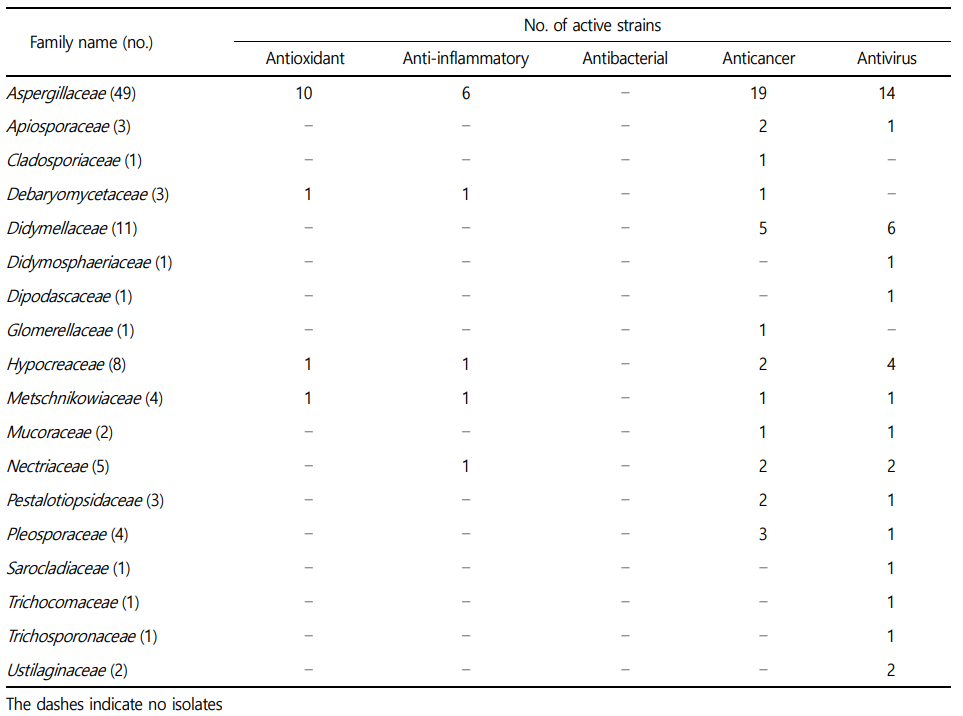
확보된 균류 70주는 3문(phylum), 7강(class), 15목(order), 21과(family), 26속(genus)에 속했다(Table 2). 대부분의 균주는 ascomycota(67주) 문에 속했고, 나머지는 basidiomycota(2주)와 mucoromycota(1주) 문에 해당되었다. Eurotiomycetes, sordario- mycetes, dothideomycetes 세 종류의 강이 전체 균주의 약 91%를 차지했고, 속 단위에서는 Penicillium과 Aspergillu가 각각 전체의 30%, 약 14%로 가장 많은 수를 차지했다.
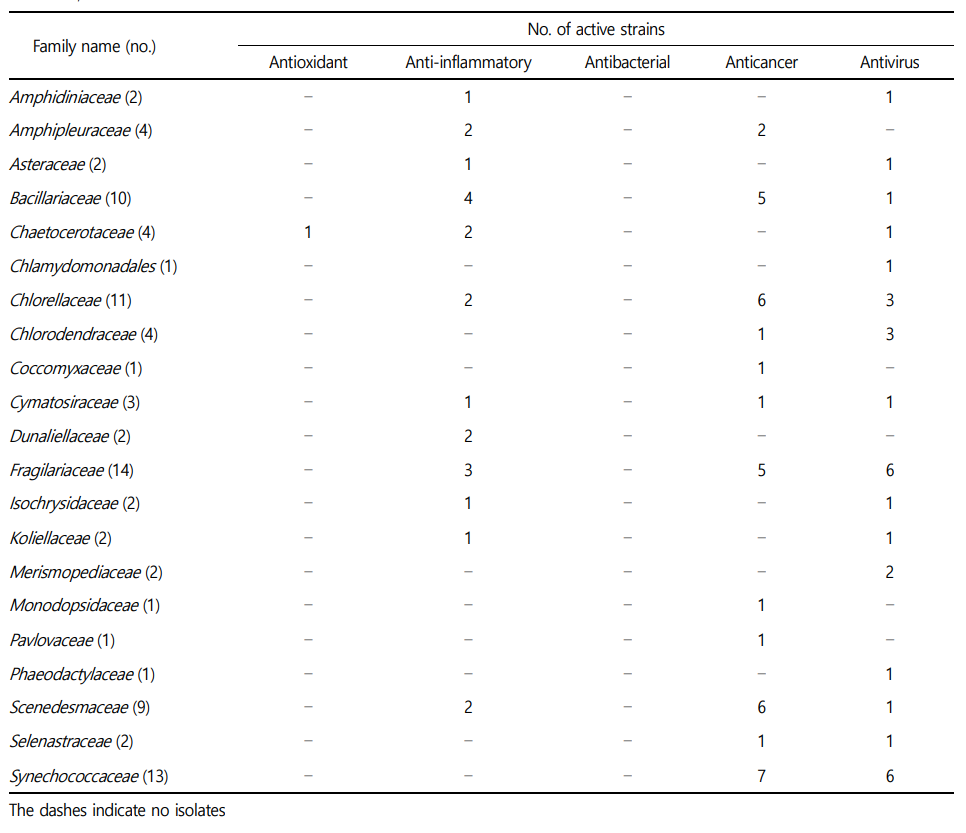
확보된 미세조류 70주는 6문(phylum), 10강(class), 17목(order), 20과(family), 31속(genus)에 속하였으며, 대부분의 균주는 Chloro- phyta(30주), Bacillariophyta(23주) 및 Cyanobacteria(11주) 문에 속하였고 기타 Ochrophta(3주), Haptophyta(2주) 및 Dinophyta (1주)에 속하는 것을 확인하였다. 강(Class) 수준에서 미세조류는 Chlorophyceae(19주), Bacillariopyceae(16주), Cyanophyceae(11주) 및 Trebouxiophyceae(8주)로 4강이 전체 분류군의 약 77퍼센트를 차지하고 있었으며, 기타 Mediiophyceae(6주), Chlorodendro- phyceae(3주), Eustigmatophyceae(3주), Coccolithophyceae(1주), Dinophyceae(1주) 및 Pavlovophyceae(1주)로 다양한 미세조류 분류군이 확보된 것을 확인할 수 있었다(Table 2).
3. 항산화 효능
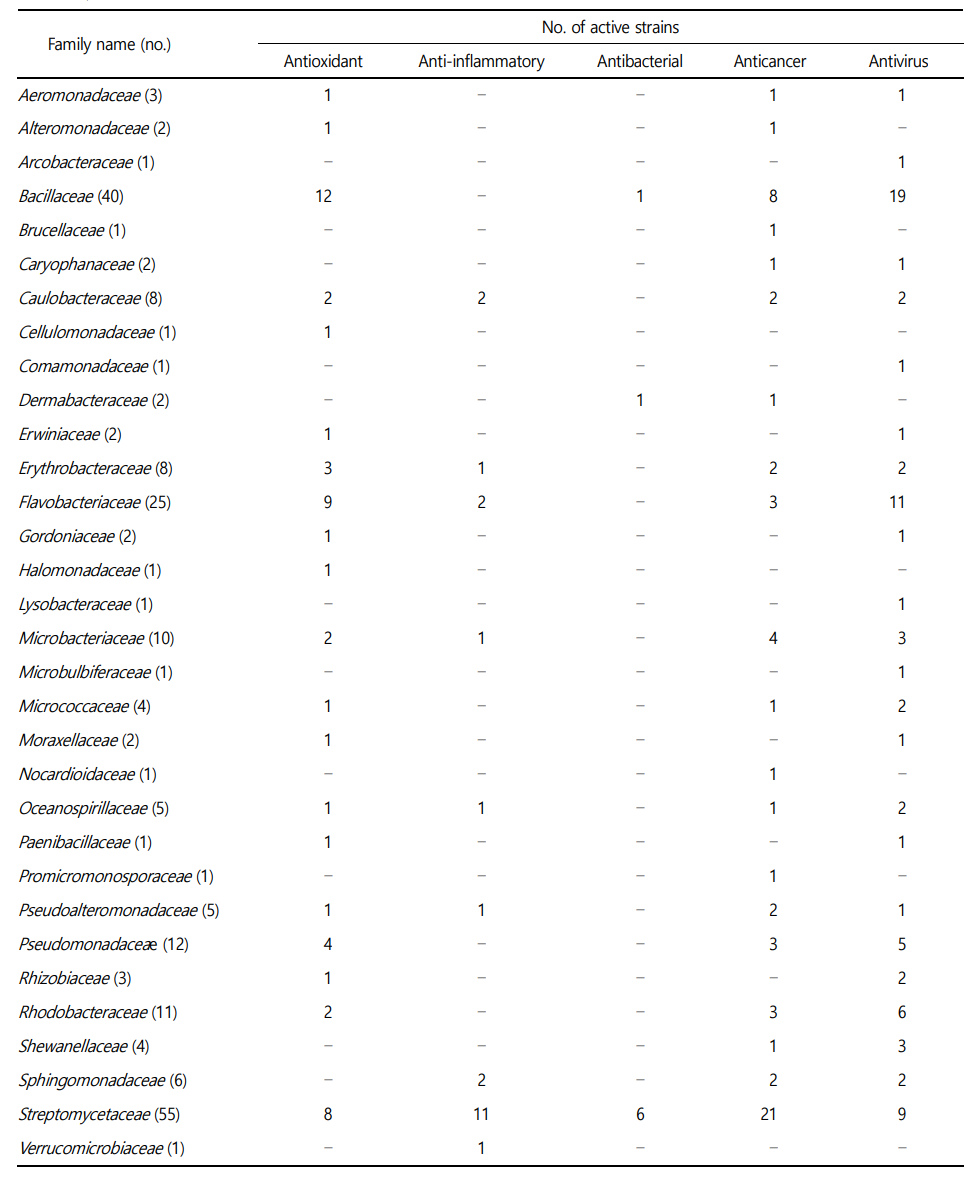
실시한 3가지(DPPH 라디칼 소거, ATBS 라디칼 소거, 세포 내 ROS 소거 효능)의 항산화 효능 실험결과 50 μg/mL 농도의 추출물을 기준으로 DPPH assay와 ABTS assay에서 60% 소거능을 보이는 시료, 세포 내 ROS 소거 효능 실험에서 세포 생존률 80% 이상, ROS 소거능 40% 초과가 되는 결과를 기준으로 항산화 효능을 보이는 자원을 선별하였다. 그 결과, 세균에서는 Bacillaceae(12주), Flavobacteriaceae(9주), Streptomycetaceae(8주), Pseudomonadaceae (4주), Erythrobacteraceae(3주) 과(family)에 속하는 균주들이 항산화 효능이 관찰되었다(Table 3). 균류에서는 주로 Aspergillaceae 과에 속하는 균주 10주가 효능이 관찰되었다(Table 4). 미세조류에서는 Chaetocerotaceae 과에 속하는 균주가 1주가 효능이 관찰되었다(Table 4). 효능이 확인된 미세조류 균주는 영양성분이 우수하고 배양이 용이하여 양식장의 먹이생물로 널리 활용되고 있는 Chaetoceros muelleri로 고부가색소인 후코잔틴(fucoxanthin)을 함유하고 있는 것으로 보고되고 있으며, 항균 효과를 보인다고 알 려져 있어 건강보조식품 및 의약품 등에 활용을 위한 연구가 활발하게 진행되고 있다(Ramos et al., 2022).
4. 항염 효능
항염 효능은 위에 언급한 두 가지 실험을 대상으로 세포 생존률 80% 이상, 저해능 40% 초과하는 자원을 선별하였다. 그 결과, 세균에서는 주로 Strepmycetaceae(11주), 균류에서는 Aspergillaceae (6주) 과(family)에 속하는 균주가 활성을 보였으며 미세조류는 Bacillariaceae(4주) 과에서 속하는 균주가 항염활성을 나타냈다(Table 3-5).
5. 항균 효능
항균 실험에 사용한 해양세균, 균류, 미세조류 배양 추출물 32 μg mL-1 농도 이하에서 실험균의 생장 저해를 보이는 균주를 선별하였다. 세균인 Streptomycetaceae(6주) 과(family)에 속하는 균주들이 주로 항균 효능이 관찰되었다(Table 3). 주로 Streptomyces 속(genus)에 속하는 균주들이 활성을 보였으며, 이들은 해양퇴적토로부터 분리한 균주들이었다.

6. 항암 효능
7종의 암세포주를 대상으로 수행한 항암 실험은 추출물 100 μg mL-1에서 억제 효능 40%를 초과하는 균주를 선별하였다. 그 결과 세균에서는 주로 Streptomycetaceae(21주), Bacillaceae(8주), Micro- bacteriaceae(4주), Flavobacteriaceae(3주), Pseudomonadaceae (3주), Rhodobacteraceae(3주) 과(family)에서 활성을 보였다(Table 3). 균류에서는 Aspergillaceae(19주), Didymellaceae(5주), Pleosporaceae (3주) 과에 속하는 균주들이 항암활성을 보였다(Table 4). 미세조류는 Chlorellaceae(6주), Scenedesmaceae(6주), Fragilariaceae(6주)가 주로 항암활성을 보였다(Table 5).
7. 항바이러스 효능
3종의 바이러스를 대상으로 수행한 항바이러스 실험은 추출물 50 μg mL-1에서 억제 효능 50% 초과하는 균주를 선별하였다. 세균에서는 Bacillaceae(19주), Flavobacteriaceae(11주), Strepto- mycetaceae(9주), Rhodobacteraceae(6주), Pseudomonadaceae(5주) 과(family)에서 주로 활성을 보이고, 균류의 경우 Aspergillaceae (14주), Didymellaceae(6주), Hypocreaceae(4주)에서 활성을 보였다(Table 3 and 4). 미세조류의 경우, 주로 Fragilariaceae(6주)와 Scenedesmacea(6주) 과에 속하는 균주들이 항바이러스 효능이 관찰되었다(Table 5).
고 찰
2년간 우리나라의 다양한 해양환경으로부터 총 370주의 해양세균, 균류, 미세조류를 분리·동정하여, 해양생물자원의 산업적 활용을 위해 기초생리활성(항산화, 항염, 항균, 항암, 항바이러스)을 채집지, 분리원, 종(種) 수준에서 평가하였다. 그 결과, 해양세균의 경우 해양세균 분리에 일반적으로 사용되는 marine agar를 단일배지로 사용하여 총 230주를 분리할 수 있었으며 채집지와 분리원 별로 보면, 서해 해역(60%)과 해양퇴적물(38%)에서 가장 높은 비율로 배양 균주가 분리되었다. 분리된 해양세균은 16S rDNA 유전자 염기서열 분석을 통해 5문, 9강, 25목, 46과 112속(genus)의 다양한 해양세균이 확인되었고 기초생리활성 분석을 통해 총 35과(family)에 속하는 균주들의 활성이 관찰되었으며, Sterpto- mycetacea, Bacillaceae, Falvobaceriaceae 순으로 가장 많은 활성 균주가 확인되었다. 특히 Sterptomycestaceae 과에 속하는 분리 균주들이 항산화, 항염, 항균, 항암, 항바이러스 활성 영역에서 최소 하나 이상 또는 모든 영역에서 활성을 나타냈다. Sterpto- mycetacea 과 속하는 대표적인, Sterptomyces 종은 육상 및 해양환경의 다양한 서식처에서 분리되며 화학적 구조가 다양하고 유용한 생리활성을 갖는 이차대사산물을 생산하는 대표 미생물 중에 하나이며 특히, 해양에서 분리된 Sterptomyces 종들은 신규한 이차대사산물을 찾는 중요한 연구 자원으로 여겨지고 있다(Quinn et al., 2020; Donald et al., 2022). 따라서 기초생리활성 조사에서 활성을 보인 해양 Sterptomyces 종들도 새로운 이차대사산물을 발견하는데 잠재적 가능성이 높은 미생물로 생각된다.
해양균류의 경우 Aspergillaceae 과에 속하는 균주들과 Didy- mellaceae 과에 속하는 균주들은 항암활성과 항바이러스 활성에서 강세를 보였다. 미세조류의 경우 Nizschia 속과 Gedaniella 속에 속하는 균주들이 다양하게 활성을 보였으며, Desmodesmus, Tetrademus, Synechococcus, Chlorella 속에 속하는 균주들이 항암 및 항바이러스활성이 두드러지게 관찰되었다. 특히 4종의 해양세균 Brevundimonas aurantiaca, 해양균류 Penicillium jianfenglingense, Metschnikowia bicuspidata, Aspergillus terreus 균주의 경우, 항균을 제외한 항산화, 항염, 항암, 항바이러스 활성에서 모두 효과를 나타내어 추후 어떠한 활성성분이 효능을 나타내는지 후속 연구가 필요하다.
본 연구를 통하여 우리나라 여러 해양환경 지역으로부터 다양한 해양세균, 균류, 미세조류로부터 기초생리활성(항산화, 항염, 항균, 항암, 항바이러스)을 조사하여 효능 특이적으로 활성을 보이는 다양한 해양미생물과 미세조류를 확보할 수 있었다. 특히, 종 특이적으로 활성이 강하게 나타나는 결과도 얻을 수 있어 추후 특정질병에 선택적으로 효능을 보이는 화학물질 연구가 가능할 것으로 생각된다. 또한 기초생리활성 스크리닝을 통해 확보한 해양미생물과 미세조류자원은 산업적 활용을 위한 해양생물전략소재 개발연구의 기초자료로 이용될 수 있다고 사료된다. 향후, 확보한 해양미생물과 미세조류 자원은 해양바이오뱅크에서 체계적으로 관리하고 학계, 산업계로 제공하여 활용됨으로써 해양바이오산업 활성화에도 기여할 할 것으로 기대된다.
- References
-
1. Blois MS. 1958. Antioxidant determinations by the use of a stable free radical. Nature 181: 1199-1200.
-
2. Blunt JW, Copp BR, Keyzers RA, Munro MHG, Prinsep MR. 2015. Marine natural products. Nat Prod Rep 32: 116-211.
-
3. Chung D, Baek K, Bae SS, Jung J. 2019. Identification and characterization of a marine-derived chitinolytic fungus, Acremonium sp. YS2-2. J Microbiol 57: 372-380.
-
4. Donald L, Pipite A, Subramani R, Owen J, Keyzers RA, Taufa T. 2022. Streptomyces: Still the biggest producer of new natural secondary metabolites, a current perspective. Microbiol Res 13: 418-465.
-
-
-
-
8. Kumar S, Stecher G, Li M, Knyaz C, Tamura K. 2018. MEGA X: molecular evolutionary genetics analysis across computing platforms. Mol Biol Evol 35: 1547-1549.
-
9. Kwon YM, Yang SH, Kwon KK, Kim SJ. 2014. Nonlabens antarcticus sp. nov., a psychrophilic bacterium isolated from glacier ice, and emended descriptions of Nonlabens marinus Park et al 2012 and Nonlabens agnitus Yi and Chun 2012. Int J Syst Evol Microbiol 64: 400-405.
-
10. Mayer AM, Hamann MT. 2004. Marine pharmacology in 2000: marine compounds with antibacterial, anticoagulant, anti- fungal, anti-inflammatory, antimalarial, antiplatelet, antiuber- culosis, and antiviral activities; affecting the cardiovascular, immune, and nervous systems and other miscellaneous mechanisms of action. Mar Biotechnol 6: 37-52.
-
11. Petersen LE, Kellermann MY, Schupp PJ. 2019. Secondary metabo- lites of marine microbes: from natural products chemistry to chemical ecology. YOUMARES 9 – The Oceans: our research, our future pp 159-180.
-
12. Ramos DF, Bartolomeu Halicki PC, da Silva Canielles Caprara C et al. 2022. Chemical profile and antimicrobial activity of the marine diatom Chaetoceros muelleri. Chem Biodivers 19: e202100846.
-
13. Re R, Pellegrini N, Proteggente A, Pannala A, Yang M, Rice-Evans C. 1999. Antioxidant activity applying an improved ABTS radical cation decolorization assay. Free Radic Biol Med 26: 1231-1237.
-
14. Strom SL. 2008. Microbial ecology of ocean biogeochemistry: a community perspective. Science 320: 1043-1045.
-
15. Quinn GA, Banat AM, Abdelhameed AM, Banat IM. 2020. Strepto- myces from traditional medicine: Sources of new innovations in antibiotic discovery. J Med Microbiol 69: 1040-1048.